Электрохимия — это раздел химии, изучающий физико-химические процессы протекающие на границе раздела фаз с участием заряженных частиц(электронов, ионов)
Ряд напряжений
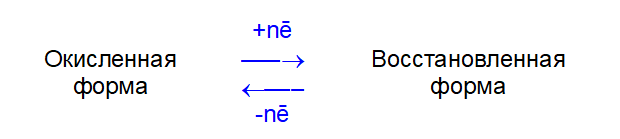
Каждая такая полуреакция характеризуется стандартным окислительно-восстановительным потенциалом Е0, (размерность — вольт, В). Чем больше Е0, тем сильнее окислительная форма и слабее восстановленная форма, и наоборот.
За точку отсчета потенциалов принята полуреакция: 2H+ + 2ē = H2, для которой Е0=0
Для полуреакций Mn+ + nē = M0, Е0 называется стандартным электродным потенциалом. По величине этого потенциала металлы принято располагать в ряд стандартных электродных потенциалов (ряд напряжений металлов):

Ряд напряжений характеризует химические свойства металлов:
- Чем левее расположен металл в ряду напряжений, тем сильнее его восстановительная способность и слабее окислительная способность его иона в растворе (т.е. тем легче он отдает электроны (окисляется) и тем труднее его ионы присоединяют электроны).
- Каждый металл способен восстанавливать из растворов солей те металлы, которые стоят в ряду напряжений правее его, (т.е. восстанавливает ионы металлов в нейтральные атомы, отдавая электроны, превращается в ион)
- Только металлы, которые стоят в ряду напряжений левее водорода (Н), способны вытеснять его из растворов кислот (например, Zn, Fe, Pb, но не Сu, Hg, Ag).
Гальванические элементы
Гальванические элементы – это химические источники постоянного электрического тока, в которых энергия химических реакций превращается в электрическую.
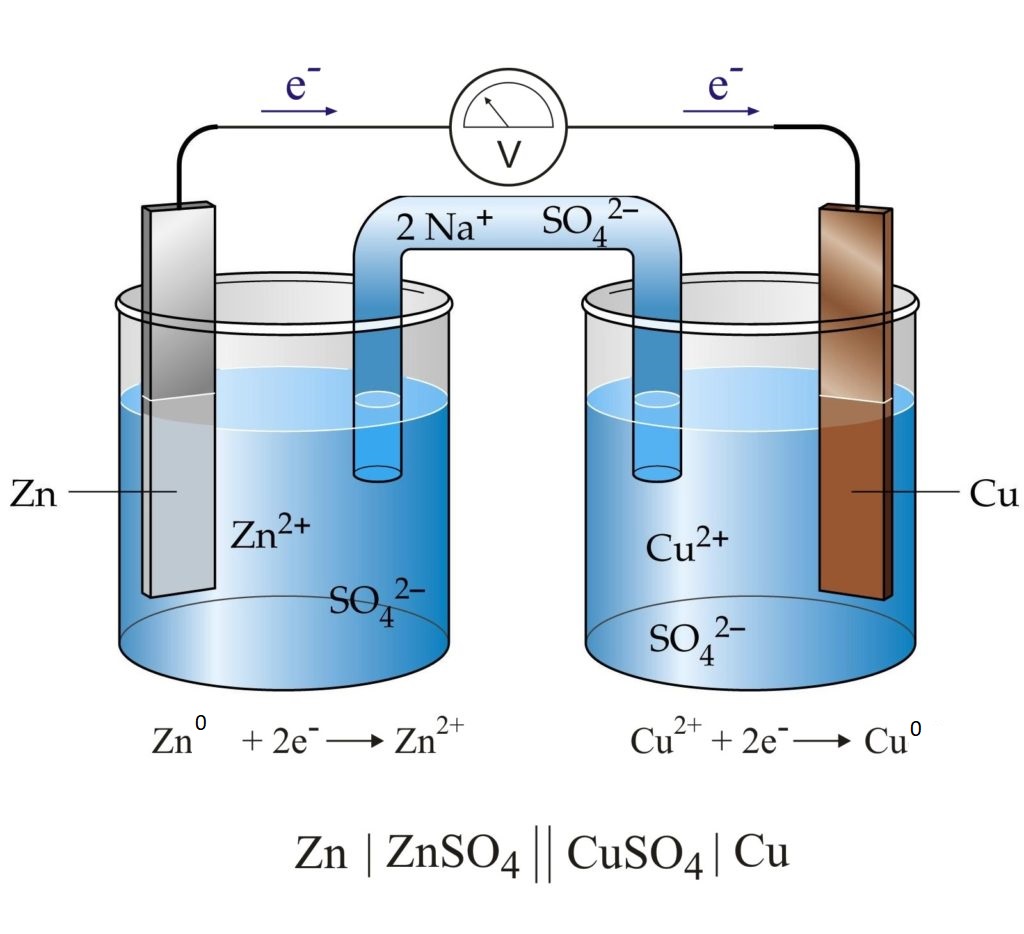
Каждые два металла, погруженные в растворы их солей, которые сообщаются между собой через ионный мостик, заполненный электролитом, образуют гальванический элемент.
Пластинки металлов, погруженные в собственные растворы, называются электродами элемента.
Если соединить наружные концы электродов гальванического элемента (полюсы элемента) проводником, то от металла, у которого величина потенциала меньше, электроны будут перемещаться к металлу, у которого она больше (например, от Zn к Cu). Уход электронов нарушает равновесие, существующее между металлом и его ионами в растворе, что вызывает окислительный процесс сопровождающийся переходом в раствор металла в виде ионов (металл постепенно растворяется). В то же время электроны, переходящие к другому металлу, разряжают у его поверхности ионы, находящиеся в растворе , превращая их в атомы (металл выделяется из раствора). Электрод, на котором протекает окисление, называется анодом, а электрод, на котором протекает восстановление — катодом. В цинково-медном элементе цинковый электрод является анодом, а медный – катодом.
Таким образом, в замкнутом гальваническом элементе происходит взаимодействие между металлом и раствором соли другого металла, не соприкасающимися непосредственно друг с другом. Атомы первого металла, отдавая электроны, превращаются в ионы, а ионы второго металла, присоединяя электроны, превращаются в атомы. Первый металл вытесняет второй из раствора его соли. Например, при работе гальванического элемента, составленного из цинка и меди, погруженных соответственно в растворы ZnSO4 и CuSO4 у электродов происходят следующие процессы:
Zn0 – 2ē = Zn2+
Cu2+ + 2ē = Cu0
Суммируя процессы окисления и восстановления, получаем
Zn + Cu2+ = Cu + Zn2+
Молекулярное уравнение реакции будет иметь вид:
Zn + CuSO4 = Cu + ZnSO4
Электродвижущая сила
Электродвижущая сила гальванического элемента равна разности потенциалов его электродов. При определении его всегда вычитают из большего потенциала меньший. Например, электродвижущая сила (Э.Д.С.) цинк-медного элемента равна:
Э.Д.С = 0,34 В — (-0,76 В) = 1,1 В
ЕCu = 0,34 В
EZn = — 0,76 В
Такую величину ЭДС будет иметь при условии, что металлы погружены в растворы, в которых концентрация ионов равна 1 г-ион/л. При других концентрациях растворов величины электродных потенциалов будут иные. Их можно вычислить по формуле:
E = E0 + (0,058 / n) • lgC
где E — искомый потенциал металла (в вольтах)
E0 — его нормальный потенциал
n — валентность ионов металла
С — концентрация ионов в растворе (г-ион/л)
Пример
Найти электродвижущую силу элемента (э. д. с.) образованного цинковым электродом, опущенным в 0,1 М раствор ZnSO4 и свинцовым электродом, опущенным в 2 М раствор PbSO4.
Решение
Вычисляем потенциал цинкового электрода:
EZn = -0,76 + (0,058 / 2) lg 0,1 = -0,76 + 0,029 • (-1) = -0,79 В
Вычисляем потенциал свинцового электрода:
EPb = -0,13 + (0,058 / 2) lg 2 = -0,13 + 0,029 • 0,3010 = -0,12 В
Находим электродвижущую силу элемента:
Э. д. с. = -0,12 – (-0,79) = 0,67 В