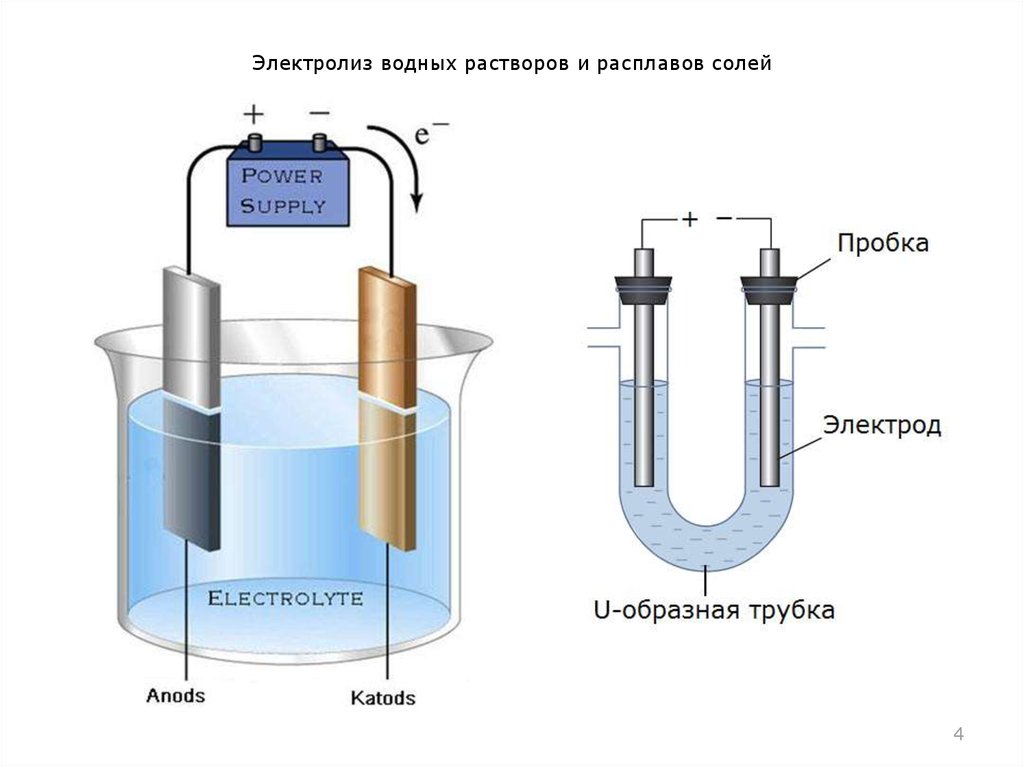
Электролизом называется физико-химический процесс получения простых веществ электрическим током.
Сущность электролиза заключается в том, что при пропускании тока через раствор электролита (или расплавленный электролит) положительно заряженные ионы перемещаются к катоду, а отрицательно заряженные – к аноду. Достигнув электродов ионы разряжаются, в результате чего у электродов выделяются составные части растворенного электролита в виде простых веществ или водород и кислород из воды.
Для перевода различных ионов в нейтральные атомы или группы атомов требуется различное напряжение электрического тока. Одни ионы легче теряют свои заряды, другие труднее. Степень легкости, с которой разряжаются (присоединяют электроны) ионы металлов, определяется положением металлов в ряду напряжений. Чем левее стоит металл в ряду напряжений, чем больше его отрицательный потенциал (или меньше положительный потенциал), тем труднее при прочих равных условиях разряжаются его ионы (легче всего разряжаются ионы Аu3+, Ag+; труднее всего Li+, Rb+, K+).
Если в растворе одновременно находятся ионы нескольких металлов, то в первую очередь разряжаются ионы того металла, у которого электродный потенциал больше. Например, из раствора, содержащего ионы Zn2+ и Cu2+, сначала выделяется металлическая медь. Но величина потенциала металла зависит также и от концентрации его ионов в растворе; точно также изменяется и легкость разряда ионов каждого металла в зависимости от их концентрации: увеличение концентрации облегчает разряд ионов, уменьшение – затрудняет. Поэтому при электролизе раствора, содержащего ионы нескольких металлов может случиться, что выделение более активного металла будет происходить раньше, чем выделение менее активного (если концентрация ионов первого металла значительна, а второго – очень мала).
В водных растворах солей, кроме ионов соли, всегда имеются еще и ионы воды (Н+ и ОН—). Из них ионы водорода будут разряжаться легче, чем ионы всех металлов, предшествующих водороду в ряду напряжений. Однако ввиду ничтожной концентрации водородных ионов при электролизе всех солей, кроме солей наиболее активных металлов, у катода происходит выделение металла, а не водорода. Только при электролизе солей натрия, кальция и других металлов до алюминия включительно разряжаются ионы водорода и выделяется водород.
У анода могут разряжаться или ионы кислотных остатков или гидроксильные ионы воды. Если ионы кислотных остатков не содержат кислорода (Cl—, S2-, CN— и др.), то обычно разряжаются именно эти ионы, а не гидроксильные, которые теряют свой заряд значительно труднее, и у анода выделяются Cl2, S и т.д. Наоборот, если электролизу подвергается соль кислородсодержащей кислоты или сама кислота, то разряжаются гидроксильные ионы, а не ионы кислородных остатков. Образующиеся при разряде гидроксильных ионов нейтральные группы ОН— тотчас же разлагаются по уравнению:
4OH— -> 2H2O + O2
В результате у анода выделяется кислород.
Электролиз расплава хлорида натрия NаCl
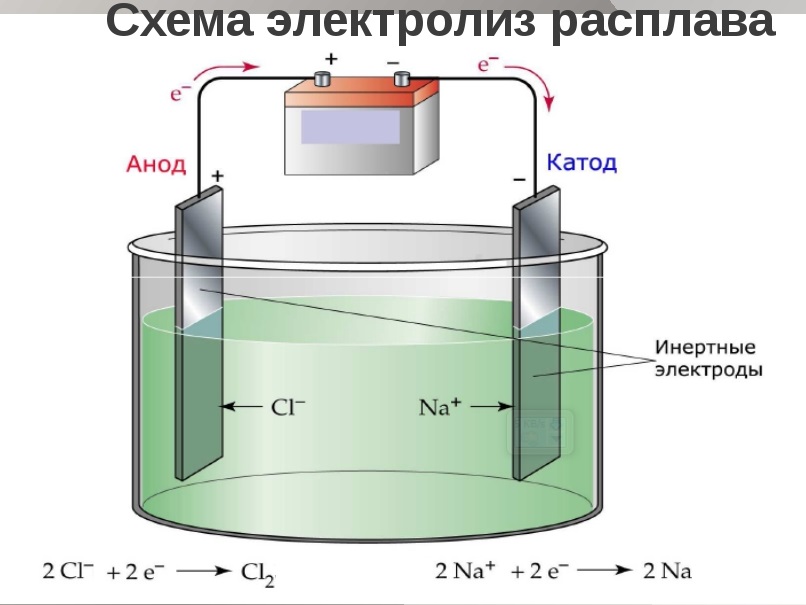
Расплав содержит ионы Nа+ и Cl—. При пропускании тока ионы Nа+ перемещаются к катоду, а ионы Cl— к аноду. Принимая от катода электроны, ионы Nа+ превращаются в нейтральные атомы. На катоде образуется металлический натрий.
Ионы хлора Cl—, достигая анода, отдают ему электроны и превращаются в атомы хлора, которые, соединяясь попарно, образуют молекулы хлора Cl2. На аноде выделяется газообразный хлор.
Таким образом, у катода происходит процесс восстановления натрия, у анода – процесс окисления хлора.
Законы электролиза (М. Фарадей)
1. Количество выделяемого при электролизе вещества пропорционально количеству протекшего через раствор электричества и практически не зависит от других факторов.
2. Равные количества электричества выделяют при электролизе из различных химических соединений эквивалентные количества веществ.
3. Для выделения из раствора электролита одного грамм-эквивалента любого вещества нужно пропустить через раствор 96500 кулонов электричества.
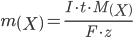
где m(x) — количество восстановленного или окисленного вещества (г);
I — сила пропускаемого тока (а);
t — время электролиза (с);
M(x) — молярная масса;
z — число приобретенных или отданных в окислительно-восстановительных реакциях электронов;
F — постоянная Фарадея (96500 кул/моль).
Исходя из этой формулы, можно производить ряд расчетов, связанных с процессом электролиза, например:
- Вычислять количества веществ, выделяемых или разлагаемых определенным количеством электричества;
- Находить силу тока по количеству выделившегося вещества и времени, затраченному на его выделение;
- Устанавливать, сколько времени потребуется для выделения определенного количества вещества при заданной силе тока.
Пример 1
Сколько граммов меди выделится на катоде при пропускании через раствор сернокислой меди СuSO4 тока силой 5 ампер в течение 10 минут?
Пример 2
Сколько времени нужно пропускать через раствор кислоты ток силой 10 ампер, чтобы получить 5,6 л водорода (при н. у.)?
Пример 3
При пропускании тока через раствор серебряной соли на катоде выделилось за 10 мин. 1 г серебра. Определите силу тока.