Подгруппа марганца
Побочная подгруппа VII группы
Свойства элементов подгруппы марганца

Физические свойства
Серебристо-белые, тугоплавкие металлы.
Химические свойства
- В ряду Mn – Tc – Re химическая активность понижается. Mn – металл средней активности, в ряду напряжений стоит до водорода и растворяется в соляной и серной кислотах:
Mn + 2H+ -> Mn2+ + H2
Re и Tc стоят в ряду напряжений после водорода. Они реагируют только с азотной кислотой:
3Tc + 7HNO3 -> 3HTcO4 + 7NO + 2H2
2. С увеличением степени окисления усиливается кислотный характер оксидов и гидроксидов. (RO – основные; R2O7 – кислотные, им соответствуют кислоты HRO4).
Марганец и его соединения
Марганец
Электронная конфигурация валентного слоя
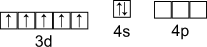
Получение
Алюмотермия: 3MnO2 + 4Al -> 2Al2O3 + 3Mn
Химические свойства
Металл средней активности. На воздухе покрывается тонкой плёнкой оксидов. Реагирует с неметаллами, например, с серой:
Mn + S -> MnS
Растворяется в кислотах:
Mn + 2HCl -> MnCl2 + H2
(При этом образуются соединения двухвалентного марганца).
Соединения Mn(II)
Оксид марганца (II) MnO получается восстановлением природного пиролюзита MnO2 водородом:
MnO2 + H2 -> MnO + H2O
Гидроксид марганца (II) Mn(OH)2 — светло-розовое нерастворимое в воде основание:
MnSO4 + 2NaOH -> Mn(OH)2¯ + Na2SO4
Mn2+ + 2OH— -> Mn(OH)2
Легко растворимо в кислотах:
Mn(OH)2 + 2HCl -> MnCl2 + 2H2O
Mn(OH)2 + 2H+ -> Mn2+ + 2H2O
На воздухе Mn(OH)2 быстро темнеет в результате окисления:
2Mn(OH)2 + O2 + 2H2O -> 2[MnO2 • 2H2O]
При действии сильных окислителей наблюдается переход Mn2+ в MnO4—:
2Mn(OH)2 + 5Br2 + 12NaOH –кат.CuSO4> 2NaMnO4 + 10NaBr + 8H2O
2Mn(NO3)2 + 5PbO2 + 6HNO3 -> 2HMnO4 + 5Pb(NO3)2 + 2H2O
2Mn(NO3)2 + 5NaBiO3 + 16HNO3 -> 2HMnO4 + 5NaNO2 + 5Bi(NO3)3 + 7H2O
Оксид марганца (IV) MnO2 — тёмно-коричневый порошок, нерастворимый в воде. Образуется при термическом разложении нитрата марганца (II):
Mn(NO3)2 –t°> MnO2 + 2NO2
При сильном нагревании теряет кислород, превращаясь в Mn2O3 (при 600°C) или Mn3O4 (при 1000°C).
Сильный окислитель:
MnO2 + 4HCl -> MnCl2 + Cl2 + 2H2O
При сплавлении с содой и селитрой образует манганат натрия тёмно — зелёного цвета:
MnO2 + Na2CO3 + NaNO3 –t°> Na2MnO4 + NaNO2 + CO2
Манганаты также могут быть получены при восстановлении перманганатов в щелочной среде:
Na2SO3 + 2KMn+7O4 + 2KOH -> Na2SO4 + 2K2Mn+6O4 + H2O
Оксид марганца (VII) Mn2O7 — тёмно-зелёная жидкость, кислотный оксид. Получают действием концентрированной серной кислоты на кристаллический KMnO4 (марганцевая кислота HMnO4 нестабильна):
2KMnO4 + H2SO4 -> Mn2O7¯ + K2SO4 + H2O
При растворении в щелочах образует перманганаты:
Mn2O7 + 2KOH -> 2KMnO4 + H2O
Перманганат калия KMn+7O4 -тёмно-фиолетовое кристаллическое вещество, растворимое в воде. При нагревании разлагается с выделением кислорода:
2KMnO4 –t°> K2MnO4 + MnO2 + O2
Сильный окислитель, причём восстанавливается в кислой среде до Mn2+, в нейтральной – до Mn+4O2, а в щелочной – до Mn+6O42-.
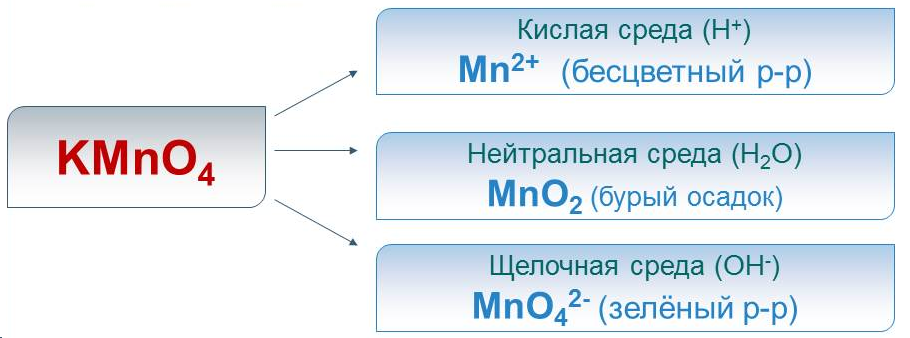
Реакции в кислой среде.
5K2S+4O3 + 2KMn+7O4 + 3H2SO4 -> 6K2S+6O4 + 2Mn+2SO4 + 3H2O
электронный баланс
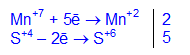
Фиолетовый раствор KMnO4 обесцвечивается при добавлении раствора K2SO3.
Реакции в нейтральной среде
3K2S+4O3 + 2KMn+7O4 + H2O -> 3K2S+6O4 +2Mn+4O2¯ + 2KOH
электронный баланс
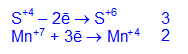
Фиолетовый раствор KMnO4 после окончания реакции обесцвечивается и наблюдается выпадение бурого осадка.
Реакции в щелочной среде.
K2S+4O3 + 2KMn+7O4 + 2KOH -> K2S+6O4 +2K2Mn+6O4 + H2O
электронный баланс
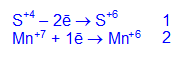
Фиолетовый раствор KMnO4 превращается в зеленоватый раствор K2MnO4.
Задачи:
- Методом электронного баланса подберите коэффициенты в схемах окислительно-восстановительных реакций:
a) NaNO2 + KMnO4 + KOH → NaNO3 + K2MnO4 + H2O
б) MnCl2 + KCIO3 + KOH → K2MnO4 + KCI + H2O
в) HCI + KMnO4 → Cl2 + MnCl2 + KCI + H2O
r) Mg + KMnO + H2SO4 → MgSO4 + MnSO4 + K2SO4 + H2O - Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
a) MnSO4 → Мп → MnCl2 → Mn(OH)2 → Mn(NO3)2
6) KMnO4 → MnO2 → MnCl2 → Мп - Вычислите массу перманганата калия, который необходим для окисления сульфита калия массой 7,9 г в нейтральной среде.
- Марганец получают восстановлением кремнием оксида марганца (ІІІ). Технический оксид массой 20 кг (массовая доля примесей равна 5,2%) восстановлен до металла. Рассчитайте массу полученного марганца.