Аллотропия
Алмаз

Кристаллическое вещество, прозрачное, сильно преломляет лучи света, очень твёрдое, не проводит электрический ток, плохо проводит тепло, r = 3,5 г/см3; t°пл. = 3730°C; t°кип. = 4830°C.
Атомы углерода находятся в sp3— гибридизации и образуют атомную кристаллическую решётку с прочными ковалентными s- связями.
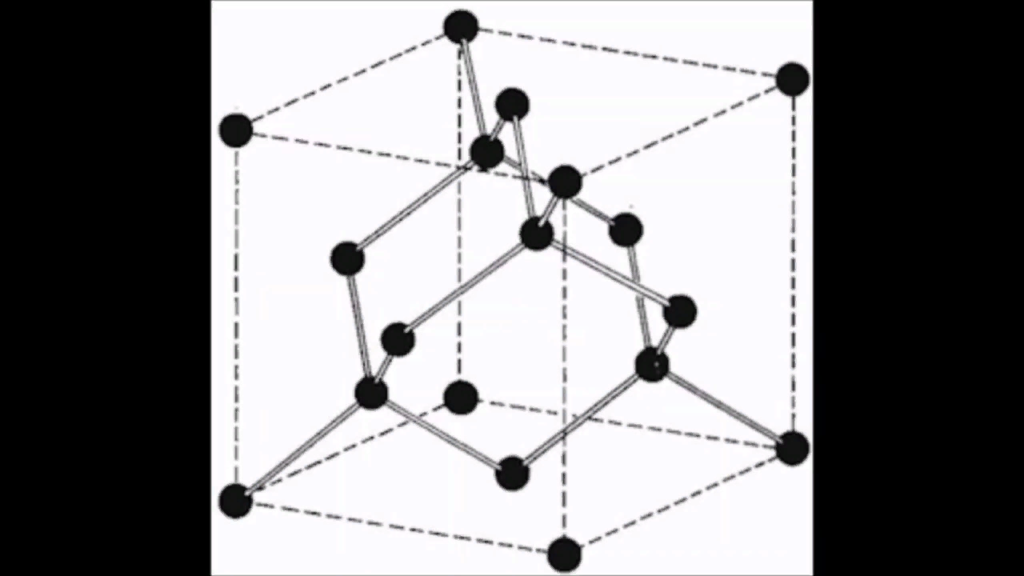
Можно получить из графита при p > 50 тыс. атм; t° = 1200°C.
Применение
Шлифовальный порошок, буры, стеклорезы, после огранки — бриллианты.
Графит

Кристаллическое вещество, слоистое, непрозрачное, тёмно-серое, обладает металлическим блеском, мягкое, проводит электрический ток; r = 2,5 г/см3.
В кристаллической решётке атомы углерода находятся в sp2— гибридном состоянии и образуют слои из шестичленных колец; между слоями действуют межмолекулярные силы.
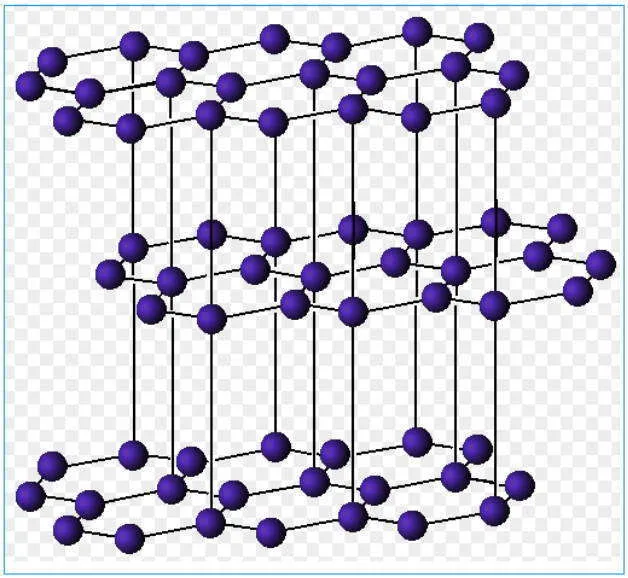
Применение
Электроды, карандашные грифели, замедлитель нейтронов в ядерных реакторах, входит в состав некоторых смазочных материалов.
Карбин

Чёрный порошок; r = 2 г/см3; полупроводник.
Состоит из линейных цепочек –C≡C–C≡C– и =С=С=С=С=; атомы углерода находятся в sp- гибридном состоянии.
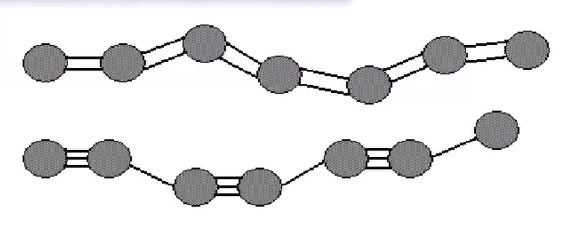
При нагревании переходит в графит.
Адсорбция
Адсорбция — поглощение газообразных или растворённых веществ поверхностью твёрдого вещества.
Обратный процесс — выделение этих поглощённых веществ — десорбция.
Применение адсорбции
Очистка от примесей (в производстве сахара и др.), для защиты органов дыхания (противогазы), в медицине (таблетки «Карболен») и др.
Химические свойства
Углерод — малоактивен, на холоде реагирует только со фтором; химическая активность проявляется при высоких температурах.
Восстановительные свойства
- с кислородом
C0 + O2 = CO2 углекислый газ
при недостатке кислорода наблюдается неполное сгорание:
2C0 + O2 = 2C+2O угарный газ
2. со фтором
С + 2F2 = CF4
3. с водяным паром
C0 + H2O = С+2O + H2 водяной газ
4. с оксидами металлов
C0 + 2CuO = 2Cu + C+4O2
5. с кислотами – окислителями:
C0 + 2H2SO4(конц.) = С+4O2 + 2SO2 + 2H2O
С0 + 4HNO3(конц.) = С+4O2 + 4NO2 + 2H2O
Окислительные свойства
6. с некоторыми металлами образует карбиды
4Al + 3C0 = Al4C3
Ca + 2C0 = CaC2-4
7. с водородом
C0 + 2H2 = CH4
Соединения углерода
Оксид углерода (II) CO
Угарный газ; бесцветный, без запаха, малорастворим в воде, растворим в органических растворителях, ядовит, t°кип = -192°C; t пл. = -205°C.
Получение
- В промышленности (в газогенераторах):
C + O2 = CO2
CO2 + C = 2CO
2. В лаборатории — термическим разложением муравьиной или щавелевой кислоты в присутствии H2SO4(конц.):
HCOOH = H2O + CO
H2C2O4 = CO + CO2 + H2O
Химические свойства
При обычных условиях CO инертен; при нагревании – восстановитель; несолеобразующий оксид.
- с кислородом
2C+2O + O2 -> 2C+4O2
2. с оксидами металлов
C+2O + CuO -> Сu + C+4O2
3. с хлором (на свету)
CO + Cl2 -> COCl2(фосген)
4. реагирует с расплавами щелочей (под давлением)
CO + NaOH -> HCOONa(муравьинокислый натрий (формиат натрия))
5. с переходными металлами образует карбонилы
Ni + 4CO -> Ni(CO)4
Fe + 5CO –> Fe(CO)5
Оксид углерода (IV) СO2
Углекислый газ, бесцветный, без запаха, растворимость в воде — в 1V H2O растворяется 0,9V CO2 (при нормальных условиях); тяжелее воздуха; t°пл.= -78,5°C (твёрдый CO2 называется «сухой лёд»); не поддерживает горение.
O=C=O
Получение
- Термическим разложением солей угольной кислоты (карбонатов). Обжиг известняка:
CaCO3 –t°> CaO + CO2
2. Действием сильных кислот на карбонаты и гидрокарбонаты:
CaCO3 + 2HCl –> CaCl2 + H2O + CO2
NaHCO3 + HCl –> NaCl + H2O + CO2
Способы собирания
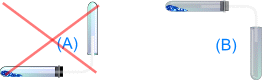
Химические свойства
Кислотный оксид: реагирует с основными оксидами и основаниями, образуя соли угольной кислоты
Na2O + CO2 –> Na2CO3
2NaOH + CO2 –> Na2CO3 + H2O
NaOH + CO2 –> NaHCO3
При повышенной температуре может проявлять окислительные свойства
С+4O2 + 2Mg –t°> 2Mg+2O + C0
Качественная реакция
Помутнение известковой воды:
Ca(OH)2 + CO2 –> CaCO3¯(белый осадок) + H2O
Оно исчезает при длительном пропускании CO2 через известковую воду, т.к. нерастворимый карбонат кальция переходит в растворимый гидрокарбонат:
CaCO3 + H2O + CO2 –> Сa(HCO3)2
Угольная кислота и её соли
H2CO3
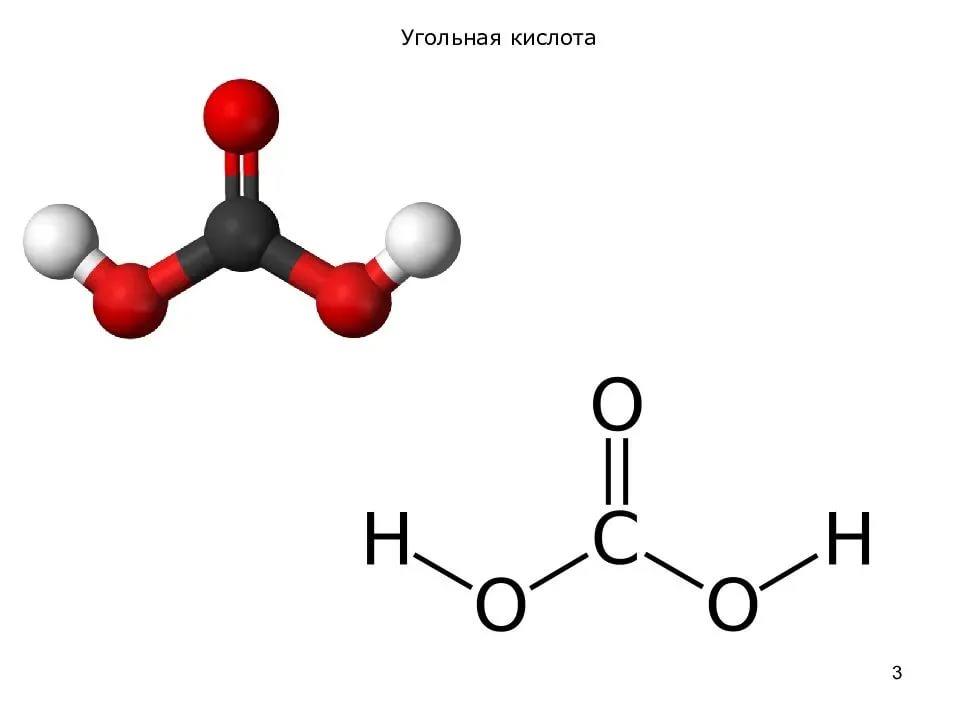
Кислота слабая, существует только в водном растворе:
CO2 + H2O ⇆ H2CO3
Двухосновная:
H2CO3 ⇆ H+ + HCO3—
HCO3— ⇆ H+ + CO32-
Характерны все свойства кислот.
Cредние соли — карбонаты (СO32-).
Кислые соли — бикарбонаты, гидрокарбонаты (HCO3—).
Карбонаты и гидрокарбонаты могут превращаться друг в друга:
2NaHCO3 –t°> Na2CO3 + H2O + CO2
Na2CO3 + H2O + CO2 –> 2NaHCO3
Карбонаты металлов (кроме щелочных металлов) при нагревании декарбоксилируются с образованием оксида:
CuCO3 –t°> CuO + CO2
Качественная реакция — «вскипание» при действии сильной кислоты:
Na2CO3 + 2HCl –> 2NaCl + H2O + CO2
CO32- + 2H+ –> H2O + CO2
Применение
Углерод – один из важнейших источников энергии. Графит используется как замедлитель нейтронов в ядерных реакторах, восстановитель в металлургии, для получения электродов, лёгких термостойких углеродных материалов (углеграфитовые материалы, углепластики и др.), как твёрдая смазка. Исключительная твёрдость и высокий коэффициент преломления алмаза обусловливают его применение в режущих и абразивных материалах. Высоко ценятся гранёные и шлифованные кристаллы алмаза (бриллианты). Высокая теплопроводность алмаза (до 2000 Вт/м·К) делает его перспективным материалом для полупроводниковой техники. Карбин применяется в фотоэлементах. Сажа служит наполнителем в производстве резины, идёт на получение красок. Стеклоуглерод используется в атомной энергетике, служит для создания термостойких покрытий космических аппаратов и самолётов. В фармакологии и медицине широко используются различные формы углерода и его соединений – производные угольной кислоты и карбоновых кислот, различные гетероциклы, полимеры и другие соединения. Углеродные нанотрубки нашли применение для создания армированных термостойких прочных композиционных материалов, специальных бумаг, изготовления дисплеев.
Задачи:
- Напишите уравнения реакций, с помощью которых можно осуществить следующие превращення:
CO → CO2 → K2CO3→ CаCO3 → CO2 → Mg(HCO3)2
Уравнения реакций, протекающих в растворах, изобразите в сокращенной нонной форме. - Оксид углерода (IV), полученный действием избытка соляной кислоты на карбонат кальция массой 4 г. растворили в воде массой 2 кг. Рассчитайте массовую долю оксида углерода (IV) в полученном растворе.
- При действии избытка соляной кислоты на смесь карбоната магния и оксида магния (масса смеси равна 10 г) выделился газ объемом 2,24 л (нормальные условия). Рассчитайте массовую долю карбоната магния в исходной смеси.
- Рассчитайте массу известняка (массовая доля карбоната кальция 80%, остальное оксид кальция), который надо взять для получения оксида углерода (IV) объемом 112 л (нормальные условия).
- Определите объем оксида углерода (IV) (нормальные условия), который можно получить из известняка массой 0,5 т (массовая доля СаСО3 в известняке составляет 95%).
- Воздух содержит в качестве примеси оксид углерода (IV). При пропускании воздуха объемом 6 м3 (объем приведен к нормальным условиям) через раствор гидроксида кальция образовался карбонат кальция массой 9 г. Рассчитайте объемную долю оксида углерода (IV) в воздухе.
- При действии на карбонат кальция массой 5 г соляной кислотой (кислота в избытке) выделился хлорид кальция массой 4,5 г. Определите массовую долю выхода продукта.