Положение металлов в периодической таблице
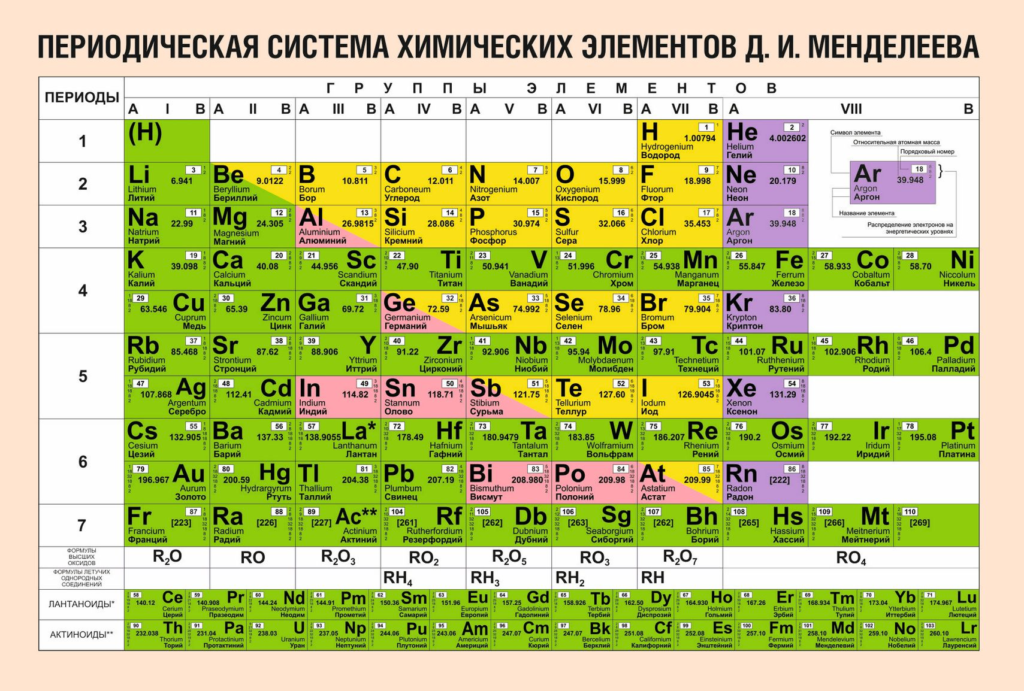
Все химические элементы, как уже отмечалось, подразделяютcя на металлы и неметаллы. К неметаллам относят 22 элемента, остальные 85 элементов (из открытых к настоящему
времени) являются металлами. Из таблицы видно, что к металлам принадлежат все элементы побочных подгрупп, включая лантаноиды и актиноиды, элементы главных подгрупп групп I (за исключением водорода), II, III (за исключением бора) и некоторые элементы главных подгрупп групп IV—VI (германий, олово, свинец, сурьма, висмут, полоний).
Некоторые элементы, которые обычно относят к металлам, — германий, сурьма, проявляют отдельные свойства, характерные для неметаллов, т. е. занимают промежуточное положение между двумя группами элементов. И наоборот, отдельные металлические свойства могут проявляться у некоторых элементов-неметаллов, например у кремния, мышьяка, теллура. Поэтому классификация элементов на металлы и неметаллы до некоторой степени условна.
Вступая в химические превращения, атомы металлов обычно отдают валентные электроны. Количественно способность атома отдавать валентные электроны характеризуется энергией ионизации. Это энергия, которую необходимо затратить на отрыв электрона от атома. О легкости отдачи электронов атомами металлов можно судить по низким значениям их энергии ионизации.
Легкость отдачи электронов возрастает с уменьшением числа электронов на внешнем энергетическом уровне и с удалением внешнего энергетического уровня от атомного ядра.
В обоих случаях это обусловлено увеличением размера атома. Большинство атомов элементов-металлов имеет 1—3 электрона на внешнем энергетическом уровне, например один у натрия, два у
магния, три у алюминия. У некоторых металлов на внешнем уровне атома располагаются четыре или пять электронов (на четвертом, пятом или шестом энергетическом уровне).
Следовательно, способность атомов отдавать электроны и металличность элементов в периодах будет уменьшаться, а в подгруппах увеличиваться с ростом порядкового номера элемента.
Если в периодической таблице элементов Д.И.Менделеева провести диагональ от бора(В) к астату(At), то слева внизу по диагонали будут находиться элементы-металлы (к ним же относятся все элементы побочных подгрупп), а справа вверху – элементы-неметаллы. Элементы, расположенные вблизи диагонали (Be, Al, Ti, Ge, Nb, Sb и др.), обладают двойственным характером.
К элементам — металлам относятся s — элементы I и II групп, все d- и f — элементы, а также p- элементы главных подгрупп: III (кроме бора), IV (Ge, Sn, Pb), V (Sb,Bi) и VI (Po). Наиболее типичные элементы – металлы расположены в начале периодов (начиная со второго периода).
Металлы в природе.
Природные соединения металлов.
Большинство металлов входят в состав различных природных соединений, которые называтся минералами. Например, железо содержится в минералах магнетите Fe3O4, гематите Fe2O3, титан-в рутиле TiO2, перовските СаTiO3.

Магнетит
Некоторые металлы (золото, серебро, медь) встречаются в природе в виде простых веществ — самородных металлов.

Самородное золото
Природные минералы, из которых технологически возможно и экономически целесообразно извлекать металл, называют рудами.
В зависимости от того, какие соединения металлов входят в состав руды, они подразделяют на:
- оксидные ( Fe2O3, Al2O3 )
- сульфидные ( FeS, MoS )
- хлоридные ( NaCi, MgCl2 )
- карбонатные ( CaCO3, FeCO3 )
Руды являются основным сырьем металлургии отрасли промышленности, производящей металлы. Для извлечения металлов используют руды, содержащие металл в достаточном количестве в виде соединений, доступных для химических превращений. При этом учитывается также распространенность металла в природе. Так, титан извлекают из руд с массовой долей
TiO2 6-30%. В производстве вольфрама применяют руды, которые содержат 0,14—0,5% МО3. В состав руды кроме полезных минералов входит пустая порода.
Производство металлов включает в себя обогащение руд и металлургический процесс извлечения металлов из обогащенных руд.
Обогащение руд.
Обогащение руд — это процесс отделения пустой породы в целях повышения содержания в руде металла.
Наиболее эффективным методом обогащения руд является флотация.
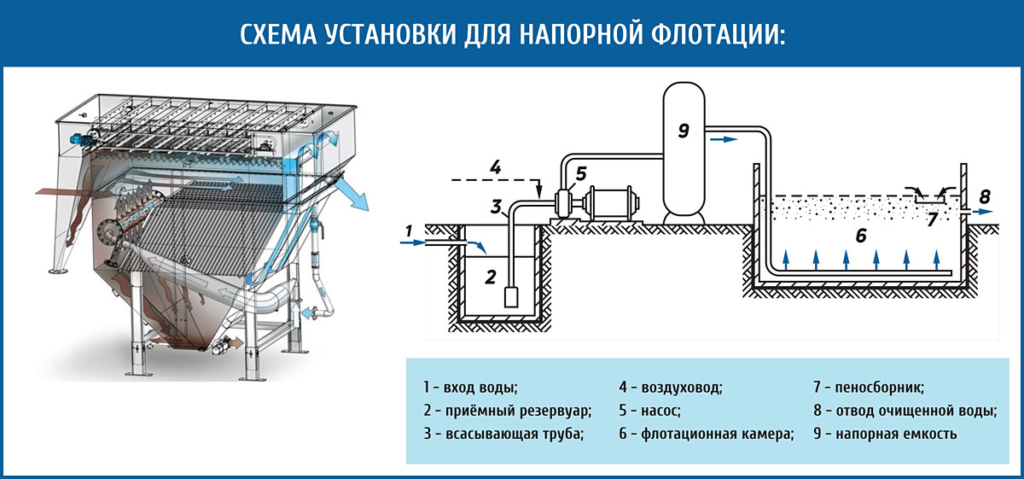
Процесс флотации основан на различной смачиваемости водой пустой породы и полезного минерала. Флотационный процесс проводят с помощью флотационных реагентов(ф.р.- это вещества, которые избирательно адсорбируются на поверхности частиц полезного минерала и не адсорбируются на пустой породе) Это специальные по составу вещества,которые избирательно адсорбируются на поверхности частиц полезного минерала и не адсорбируются на частицах пустой породы.
В результате адсорбции флотационных реагентов частицы полезного минерала приобретают способность не смачиваться водой.
Для проведения флотации измельченную руду помещают в емкость с водой, в которой растворяют флотационные реагенты, и через раствор пропускают воздух. Пузырьки прикрепляются к частицам минерала, которые не смачиваются водой, и поднимают их на поверхность раствора. Хорошо же
смачиваемые частицы пустой породы не прилипают к пузырькам воздуха и оседают на дно емкости. Обогащенную руду собирают с поверхности раствора.
Руды, полезные минералы которой обладают магнитными свойствами(железо, кобальт, никель), обогащают методом магнитной сепарации, суть которой заключается в следующем: измельчённую руду подают на транспортёр, вращаемый барабаном с элекромагнитом.
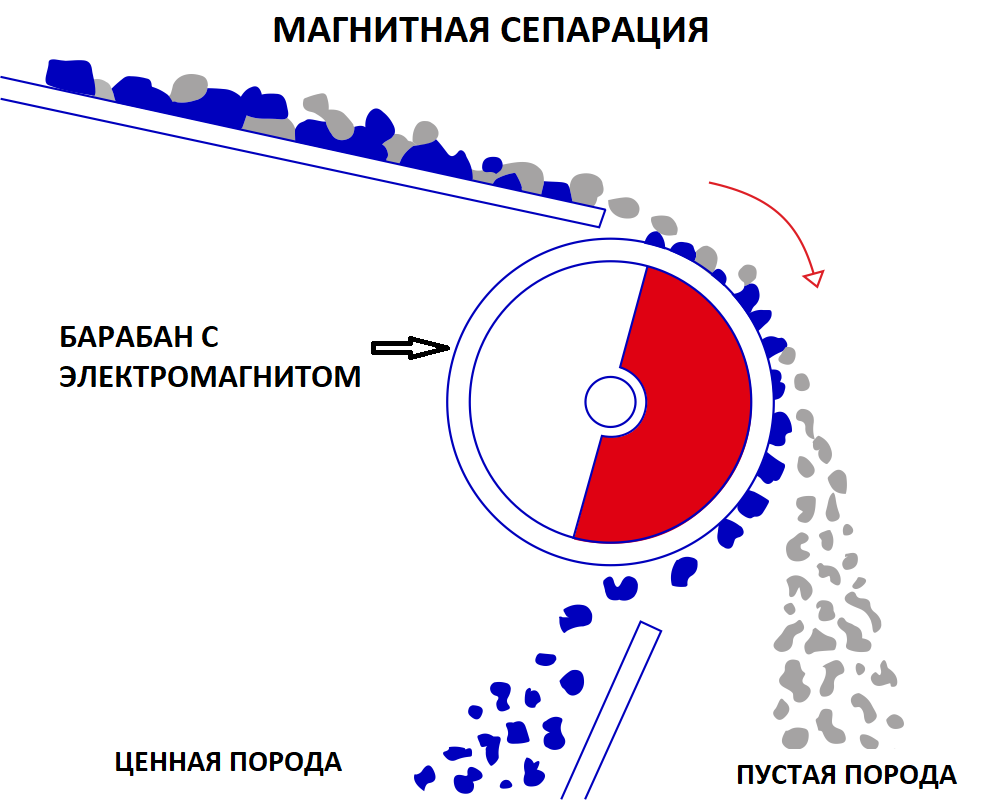
В результате пустая порода, не задерживаемая магнитом перемещается дальше, чем ценная, таким образом происходит разделение.
Имеются и другие способы обогащения, а также комбинации из них.
Металлургия
Металлургия – это отрасль промышленности, которая занимается производством металлов из руд.
Для извлечения металла рудный концентрат подвергают восстановлению. По условиям процесса различают пиро- и гидро-металлургические методы.
Пирометаллургия – это процесс получения металлов восстановлением их соединений при высоких температурах.

Гидрометаллургия — это процесс получения металлов восстановлением их соединений в водных растворах.

По применяемому восстановителю классифицируют на:
- Карботермия (С, СО)
NiO + C -> Ni + CO
Fe3O4 + 4CO -> 3Fe + 4CO2 - Восстановление водородом H2
MoO3 + 3H2 -> Mo + 3H2O
3. Восстановление с помощью активных металлов(Al,Mg,Ca,Na) – металлотермия.
Mn2O3 + 2Al -> 2Mn + Al2O3
4. Восстановление электролизом расплавов и водных растворов (см. электролиз)
Производство металлов высокой чистоты.
В науке и технике необходимы металлы с малым содержанием примесей, т.к. их наличие очень сильно изменяют свойства металлов.
Существуют следующие методы получения металлов высокой чистоты:
- Электрорафинирование(окисляют м., проводят электролиз расплава

2. Дистилляция(испаряют металл, а затем конденсируют)

3. Метод зонной плавки (используют различие коэф. растворимости примесей в жидком и твердом металле)

Задачи:
1. Медная руда содержит минерал малахит CuCO3 · Cu(OH)2 (массовая доля 7%). Вычислите массу
меди, которая может быть получена из образца такой руды массой 500 г.
2. Из образца титановой руды массой 250 г получили титан массой 40 г. Руда содержит титан в составе минерала ильменита FeTiO3. Рассчитайте массовые доли ильменита и пустой породы в руде.
3. Вольфрам получают, восстанавливая оксид вольфрама (VI) водородом. Вычислите объем водорода, приведенный к нормальным условиям, который потребуется для восстановления концентрата вольфрамовой руды массой 200 кг (массовая доля WO, в концентрате равна 92,8%).
4. Для получения никеля используют реакцию восстановления оксида никеля (II) углеродом (NiO+C
=Ni+CO). Определите массу угля, который необходимо взять для получения никеля массой 295 г, если массовая доля углерода в угле составляет 92%. Учтите, что для реакции нужен двукратный избыток углерода.
5. Из медной руды массой 8 т получили технический металл массой 325 кг (массовая доля меди 98,46%). Определите массовую долю халькозина Cu,S в руде, если других медьсодержащих компонентов в ней нет.
6. Методом электронного баланса подберите ко’ффициенты в схемах реакций, которые лежат в основе процессов получения металлов:
a) V2O5 + Ca → V + CaO
6) TiCl4 + Mg → Ti + MgCl2
s) Fe203 + CO → Fe + CO2
r) Cr203 + Al → Al2O3 + Cr