К предельным углеводородам – алканам (парафинам) относятся соединения с открытой цепью, в которых атомы углерода соединены друг с другом простыми (одинарными) связями, а остальные свободные их валентности насыщены атомами водорода. В обычных условиях алканы мало реакционноспособны, откуда возникло их название «парафины» – от лат. parrum affinis – малоактивный.
Члены гомологического ряда предельных углеводородов отвечают общей формуле CnH2n+2. Простейшим представителем насыщенных углеводородов является метан, структурная формула которого.
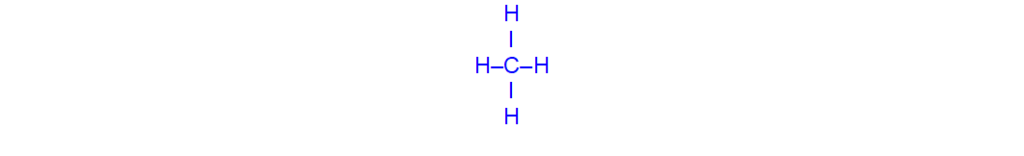
Строение молекулы метана
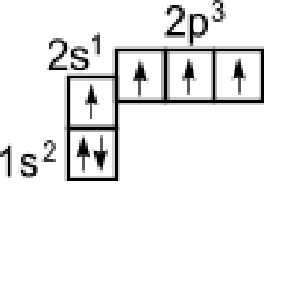
Приведенная структурная формула метана не отражает пространственного строения молекулы. Для рассмотрения этого строения необходимо вспомнить о формах электронных облаков и электронном строении атома углерода. Электронное строение атома углерода изображается следующим образом: 1s22s22p2 или схематически

Как видно, в основном состоянии на внешней оболочке имеются два неспаренных электрона, следовательно углерод должен быть двухвалентен. Однако в подавляющем большинстве случаев углерод в органических соединениях четырехвалентен. Это связано с тем, что при образовании ковалентной связи атом углерода переходит в возбужденное состояние, при котором электронная пара на 2s- орбитали разобщается и один электрон занимает вакантную p-орбиталь. В результате имеется уже не два, а четыре неспаренных электрона.
Поскольку эти четыре электрона различны (2s- и 2p- электроны), то должны бы быть различны и связи у атома углерода, однако однозначно показано, что связи в молекуле метана равнозначны. Оказывается при «смешении» четырех орбиталей возбужденного атома углерода (одной 2s- и трех 2p- орбиталей) образуются четыре равноценные sp3— гибридные орбитали. Они имеют форму гантели, одна из половин которой значительно больше другой. Вследствие взаимного отталкивания sp3— гибридные орбитали направлены в пространстве к вершинам тетраэдра и углы между ними равны 109°28′ (наиболее выгодное расположение).
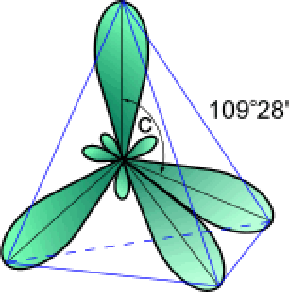
sp3— Гибридизация характерна для атомов углерода в насыщенных углеводородах (алканах) – в частности, в метане.
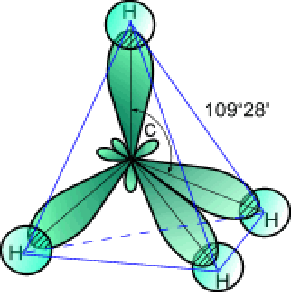
Схема электронного строения молекулы метана показывает, что каждая sp3— гибридная орбиталь при перекрывании с s- орбиталью атомов водорода образует с ними четыре, так называемые, s- связи. s- Связь – это одинарная ковалентная связь, образованная при перекрывании орбиталей по прямой, соединяющей ядра атомов, с максимумом перекрывания на этой прямой. Атом углерода в молекуле метана расположен в центре тетраэдра, атомы водорода – в его вершинах, все валентные углы между направлениями связей равны между собой и составляют угол 109°28′. Следует отметить, что в молекуле этана (CH3–CH3) одна из семи s- связей (С–С) образуется в результате перекрывания двух sp3— гибридных орбиталей атомов углерода.
Образование молекулы этана перекрыванием двух гибридных электронных облаков атомов углерода.
Изомерия
Первые три члена гомологического ряда алканов – метан, этан, пропан – не имеют изомеров. Четвертый член – бутан C4H10 отличается тем, что имеет два изомера: нормальный бутан с неразветвленной углеродной цепью и изобутан с разветвленной цепью.
CH3–CH2–CH2–CH3(нормальный бутан)
| CH3 I CH3–CH–CH3(изобутан) |
Вид изомерии, при которой вещества отличаются друг от друга порядком связи атомов в молекуле, называется структурной изомерией или изомерией углеродного скелета.
Число изомеров возрастает с увеличением в молекуле углеводорода числа углеродных атомов. Так, у пентана их 3, у гексана — 5, у гептана — 9, у октана — 18, нонана — 35, а у декана C10H22 – уже 75.
Углеводородные цепи молекул алканов могут вращаться вокруг простых связей, принимать различные геометрические формы и переходить друг в друга. Различные геометрические формы молекул, переходящие друг в друга путем поворота вокруг C–C связей, называются конформациями или поворотными изомерами (конформерами), а данный вид изомерии – конформационной (поворотной) изомерией.
Конформационная изомерия этана
“Поскольку атомы углерода, связанные одинарной, так называемой, s(сигма)- связью, могут свободно вращаться друг относительно друга, «для молекулы этана возможно бесконечное число различных расположений атомов водорода в пространстве. Эти незакрепленные, постоянно меняющиеся расположения атомов в пространстве, называются конформациями.
Конформации отличаются потенциальной энергией, т. к. атомы водорода и связи C–Н отталкиваются друг от друга тем сильнее, чем ближе друг к другу они находятся. Из бесконечного числа конформаций этана можно выделить две предельные: обладающую максимальной энергией, когда атомы водорода при разных атомах углерода наиболее приближены друг к другу (такая конформация называется заслоненной), и обладающую минимальной энергией, когда атомы водорода наиболее удалены друг от друга (такая конформация называется заторможенной). Разность энергий предельных конформаций 12 кДж/моль. Эта величина достаточно велика, чтобы утверждать, что в данный момент времени абсолютное большинство молекул этана находятся в заторможенной конформации. Вместе с тем эта величина слишком мала, чтобы препятствовать вращению одной метильной группы относительно другой.
В более сложных органических молекулах возможна большая разность энергий конформаций и тогда вращение относительно одинарной связи может быть затруднено или отсутcтвовать вообще.”
Получение
- Предельные углеводороды от C1 до C11 выделяют фракционной перегонкой нефти, природного газа или смесей углеводородов, получаемых гидрированием угля. Реакции гидрирования угля под давлением, гидрирования окиси или двуокиси углерода в присутствии катализаторов (железо, кобальт, никель) при повышенной температуре имеет важное самостоятельное значение для получения предельных углеводородов.
n C + (n+1) H2 ––400°С,p> CnH2n+2
n CO + (2n+1) H2 ––200°С,Ni> CnH2n+2+ n H2O
2. Алканы получают гидрированием непредельных или циклических углеводородов в присутствии катализаторов (платины, палладия, никеля).
R–CH=CH–R’ + H2 ––kat> R–CH2–CH2–R’
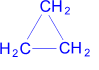
(циклопропан) + H2 ––Pd> CH3 –CH2 –CH3(пропан)
3. Получение алканов можно осуществить реакцией Вюрца, заключающейся в действии металлического натрия на моногалогенопроизводные углеводородов.
2CH3–CH2Br(бромистый этил) + 2Na -> CH3–CH2–CH2–CH3(бутан) + 2NaBr
4. В лабораторной практике предельные углеводороды получают декарбоксилированием карбоновых кислот при сплавлении их со щелочами. Так получают метан при нагревании ацетата натрия с гидроксидом натрия.
CH3COONa + NaOH ––t°> CH4 + Na2CO3
- Метан также можно получить гидролизом карбида алюминия.
Al4C3 + 12H2O -> 3CH4 + 4Al(OH)3
Физические свойства
В обычных условиях первые четыре члена гомологического ряда алканов – газы, C5–C17 – жидкости, а начиная с C18 – твердые вещества. Температуры плавления и кипения алканов их плотности увеличиваются с ростом молекулярной массы. Все алканы легче воды, в ней не растворимы, однако растворимы в неполярных растворителях (например, в бензоле) и сами являются хорошими растворителями.
Физические свойства некоторых алканов представлены в таблице.
Таблица. Физические свойства некоторых алканов
| Название | Формула | t°пл., °С | t°кип., °С | d420 * |
| Метан | CH4 | -182,5 | -161,5 | 0,415 (при -164°С) |
| Этан | C2H6 | -182,8 | -88,6 | 0,561 (при -100°С) |
| Пропан | C3H8 | -187,6 | -42,1 | 0,583 (при -44,5°С) |
| Бутан | C4H10 | -138,3 | -0,5 | 0,500 (при 0°С) |
| Изобутан | CH3–CH(CH3)–CH3 | -159,4 | -11,7 | 0,563 |
| Пентан | C5H12 | -129,7 | 36,07 | 0,626 |
| Изопентан | (CH3)2CH–CH2–CH3 | -159,9 | 27,9 | 0,620 |
| Неопентан | CH3–C(CH3)3 | -16,6 | 9,5 | 0,613 |
* Здесь и далее в таблицах физических свойств веществ d420 – плотность. Приводится относительная плотность, т.е. отношение плотности вещества при 20°С к плотности воды при 4°С.
Химические свойства
Предельные углеводороды в обычных условиях не взаимодействуют ни с концентрированными кислотами, ни со щелочами, ни даже с таким активным реагентом как перманганат калия. Для них свойственны реакции замещения водородных атомов и расщепления. Эти реакции вследствие прочности связей C–C и C–H протекают или при нагревании, или на свету, или с применением катализаторов.
Рассмотрим некоторые примеры реакций этого типа.
- Галогенирование. Это одна из характерных реакций предельных углеводородов. Наибольшее практическое значение имеют бромирование и хлорирование алканов.
Для изучения этих реакций необходимо просмотреть анимационный фильм «Механизм реакции бромирования алканов» (данный материал доступен только на CD-ROM). Обращаем внимание на то, что текст, сопровождающий этот фильм, в полном объеме перенесен в данный подраздел и ниже следует.
Механизм реакции бромирования алканов
Наиболее характерными реакциями предельных углеводородов являются реакции замещения водородных атомов. Они идут по цепному, свободнорадикальному механизму и протекают обычно на свету или при нагревании. Замещение атома водорода галогеном легче всего идет у менее гидрогенизированного третичного атома углерода, затем у вторичного и в последнюю очередь у первичного. Эта закономерность объясняется тем, что энергия связи атома водорода с первичным, вторичным и третичным атомами углерода неодинакова: она составляет соответственно 415, 390 и 376 кДж/моль.
Рассмотрим механизм реакции бромирования алканов на примере метилэтилизопропилметана:
| CH3 \ CH–CH–CH2–CH3 ––Br2,hn> / I CH3 CH3 | CH3 Br \ I CH–C–CH2–CH3 + HBr / I CH3 CH3 |
В обычных условиях молекулярный бром практически не реагирует с насыщенными углеводородами. Только в атомарном состоянии он способен вырывать атом водорода из молекулы алкана. Поэтому предварительно необходим разрыв молекулы брома до свободных атомов, которые зарождают цепную реакцию. Такой разрыв осуществляется под действием света, то есть при поглощении световой энергии молекула брома распадается на атомы брома с одним неспаренным электроном.
| .. .. :Br:Br: .. .. | ––hn> | .. .. :Br. + .Br: (зарождение цепи) .. .. |
Такой тип распада ковалентной связи называется гомолитическим расщеплением (с греческого homos – равный).
Образующиеся атомы брома с неспаренным электроном очень активны. При их атаке молекулы алкана происходит отрыв атома водорода от алкана и образование соответствующего радикала.
| CH3 \ | H | CH3 \ | • |
| CH– | C–CH2–CH3 + •Br -> | CH– | C–CH2–CH3 + HBr (рост цепи) |
| / CH3 | I CH3 | / CH3 | I CH3 |
Частицы, имеющие неспаренные электроны и обладающие в связи с этим неиспользованными валентностями, называются радикалами.
При образовании радикала атом углерода с неспаренным электроном меняет гибридное состояние своей электронной оболочки: от sp3 в исходном алкане до sp2 в радикале. Из определения sp2— гибридизации следует, что оси трех sp2— гибридных орбиталей лежат в одной плоскости, перпендикулярно к которой расположена ось четвертой атомной р- орбитали, не затронутой гибридизацией. Именно на этой негибридизованной р- орбитали находится в радикале неспаренный электрон.
Образующийся в результате первой стадии роста цепи радикал атакуется далее исходной молекулой галогена.
| CH3 \ | • | .. | .. | CH3 \ | Br I | .. | ||
| CH– | C–CH2 –CH3 + | :Br | :Br: | > | CH– | C–CH2–CH3 + | :Br: (рост цепи) | |
| / CH3 | I CH3 | .. | .. | / CH3 | I CH3 | .. |
- Нитрование. Несмотря на то, что в обычных условиях алканы не взаимодействуют с концентрированной азотной кислотой, при нагревании их до 140°С с разбавленной (10%-ной) азотной кислотой под давлением осуществляется реакция нитрования – замещение атома водорода нитрогруппой (реакция М.И.Коновалова). В подобную реакцию жидкофазного нитрования вступают все алканы, однако скорость реакции и выходы нитросоединений низкие. Наилучшие результаты наблюдаются с алканами, содержащими третичные углеродные атомы.
| NO2 I | ||
| CH3– | CH–CH3(2- метилпропан) +…HNO3 ––t°,p® CH3– I CH3 | C–CH3(2-нитро-2-метилпропан) + H2O I CH3 |
Реакция нитрования парафинов – радикальный процесс. Обычные правила замещения, рассмотренные выше, действуют и здесь.
Отметим, что в промышленности получило распространение парофазное нитрование — нитрование парами азотной кислоты при 250-500°С.
- Крекинг. При высокой температуре в присутствии катализаторов предельные углеводороды подвергаются расщеплению, которое называется крекингом. При крекинге происходит гомолитический разрыв углерод-углеродных связей с образованием насыщенных и ненасыщенных углеводородов с более короткими цепями.
CH3–CH2–CH2–CH3(бутан) ––400°C-> CH3–CH3(этан) + CH2=CH2(этилен)
Повышение температуры процесса ведет к более глубоким распадам углеводородов и, в частности, к дегидрированию, т.е. к отщеплению водорода. Так, метан при 1500ºС приводит к ацетилену.
2CH4 ––1500°C> H–CºC–H(ацетилен) + 3H2
- Изомеризация. Под влиянием катализаторов при нагревании углеводороды нормального строения подвергаются изомеризации — перестройке углеродного скелета с образованием алканов разветвленного строения.
| CH3–CH2–CH2–CH2–CH3(пентан) ––t°,AlCl3® CH3–> | CH–CH2–CH3(2- метилбутан) I CH3 |
- Окисление. В обычных условиях алканы устойчивы к действию кислорода и окислителей. При поджигании на воздухе алканы горят, превращаясь в двуокись углерода и воду и выделяя большое количество тепла.
CH4 + 2O2 ––пламя> CO2 + 2H2O
C5H12 + 😯2 ––пламя> 5CO2 + 6H2O
Алканы – ценное высококалорийное топливо. Сжигание алканов дает тепло, свет, а также приводит в движение многие машины.
Применение
Первый в ряду алканов – метан – является основным компонентом природных и попутных газов и широко используется в качестве промышленного и бытового газа. Перерабатывается в промышленности в ацетилен, газовую сажу, фторо- и хлоропроизводные.
Низшие члены гомологического ряда используются для получения соответствующих непредельных соединений реакцией дегидрирования. Смесь пропана и бутана используется в качестве бытового топлива. Средние члены гомологического ряда применяются как растворители и моторные топлива. Высшие алканы используются для производства высших жирных кислот, синтетических жиров, смазочных масел и т.д.