Общая характеристика элементов главной подгруппы V группы
(подгруппы азота)
Таблица. Электронное строение и физические свойства
| Поряд- ковый № | Элемент | Относит. атомная масса | Электронная конфигурация | Атомный радиус, нм | ПИ эВ | ЭО | Степени окисления | t°пл. °С | t°кип. °С | r г/см3 |
| 7 | Азот (N) | 14,01 | [He] 2s22p3 | 0,075 | 14,5 | 3,0 | -3, -2, -1, +1, +2, +3, +4, +5 | -210 | -196 | |
| 15 | Фосфор (P) | 30,97 | [Ne] 3s23p3 | 0,110 | 10,5 | 2,1 | -3, +1, +3, +5 | 44,1 | 280 | 1,83 |
| 33 | Мышьяк (As) | 74,92 | [Ar] 3d104s24p3 | 0,121 | 9,8 | 2,0 | -3, +3, +5 | 613 | 5,7 | |
| 51 | Сурьма (Sb) | 121,75 | [Kr] 4d105s25p3 | 0,141 | 8,6 | 1,9 | -3, +3, +4, +5 | 630,7 | 1750 | 6,68 |
| 83 | Висмут (Bi) | 208,98 | [Xe] 4f145d106s26p3 | 0,152 | 7,8 | 1,9 | +3, +5 | 271,3 | 1560 | 9,78 |
В ряду – N – P – As – Sb – Bi увеличиваются размеры атомов, ослабляется притяжение валентных электронов к ядру, ослабляются неметаллические свойства, возрастают металлические свойства, ЭО уменьшается.
N, P — типичные неметаллы
As, Sb — проявляют неметаллические и металлические свойства
Bi — типичный металл
P, As и Bi существуют в твердом состоянии в нескольких модификациях.
Химические свойства
- Основной характер оксидов R2O5 увеличивается, а кислотный – ослабевает с увеличением порядкового номера.
- Гидроксиды всех элементов в пятивалентном состоянии имеют кислотный характер.
- Основной характер гидроксидов R(OH)3 увеличивается, а кислотный – ослабевает с увеличением порядкого номера.
4. As, Sb, и Bi плохо растворимы в воде
5. Восстановительные свойства водородных соединений RH3 усиливаются, а устойчивость уменьшается с увеличением порядкого номера.
АЗОТ
N
:N≡N:
Открыт Д.Резерфордом в 1772 г. Основной компонент воздуха (78% по объему, 75,6% по массе).
В молекуле имеются одна s- и две p- связи.
Физические свойства
Газ, без цвета, запаха и вкуса; плохо растворим в воде (в 100V H2O растворяется 1,54V N2 при t°=20°С и p = 1 атм); t°кип.=-196°C; t°пл.=-210°C.
Получение
- Промышленный способ. Перегонка жидкого воздуха.
- Лабораторный способ. Разложение нитрита аммония:
NH4NO2 –t°> N2 + 2H2O
Химические свойства
Молекула азота (:N≡N:)
Очень устойчива (три ковалентные связи), поэтому обладает низкой реакционной способностью.
Восстановитель N20 -> 2N+2
Высокая температура (электрическая дуга, 3000°С)
N20 + O2 = 2N+2O
(в природе — во время грозы)
Окислитель N20 -> 2N-3
- c водородом (500°С, kat, p)
N20 + 3H2 = 2N-3HЗ
2. с активными металлами (с щелочными и щел.зем. металлами)
6Li + N20 = 2LiЗN-3
3Mg + N20 = MgЗN2-3
СОЕДИНЕНИЯ АЗОТА
АММИАК
NH3
Строение
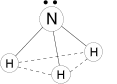
Молекула полярная, имеет форму треугольной пирамиды с атомом азота в вершине, ÐHNH = 107,3°. Атом азота находится в sp3— гибридном состоянии; из четырех гибридных орбиталей азота три участвуют в образовании одинарных связей N–H, а четвертая связь занята неподеленной электронной парой.
Физические свойства
NH3 — бесцветный газ, запах резкий, удушливый, ядовит, легче воздуха.
r по воздуху = MNH3 / M ср.воздуха = 17 / 29 = 0,5862
t° кип.= -33,4°C; t°пл.= -78°C.
Молекулы аммиака связаны слабыми водородными связями
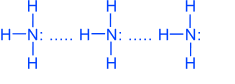
Благодаря водородным связям, аммиак имеет сравнительно высокие t°кип. и t°пл., а также высокую теплоту испарения, он легко сжимается.
Хорошо растворим в воде: в 1V Н2O растворяется 750V NH3 (при t°=20°C и p=1 атм).
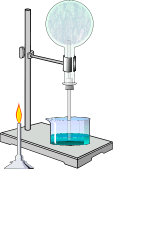
В хорошей растворимости аммиака можно убедиться на следующем опыте. Сухую колбу наполняют аммиаком и закрывают пробкой, в которую вставлена трубка с оттянутым концом. Конец трубки опускают в воду и колбу немного подогревают. Объем газа увеличивается, и немного аммиака выйдет из трубки. Затем нагревание прекращают и, вследствие сжатия газа некоторое количество воды войдет через трубку в колбу. В первых же каплях воды аммиак растворится, в колбе создастся вакуум и вода, под влиянием атмосферного давления будет подниматься в колбу, — начнет «бить фонтан».
Получение
- Промышленный способ
N2 + 3H2 = 2NH3
(p=1000 атм; t°= 500°C; kat = Fe + алюмосиликаты; принцип циркуляции).
2. Лабораторный способ. Нагревание солей аммония со щелочами.
2NH4Cl + Ca(OH)2 = CaCl2 + 2NH3 + 2Н2O
(NH4)2SO4 + 2KOH = K2SO4 + 2NH3 + 2Н2O
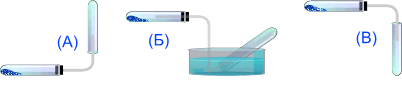
Аммиак можно собирать только по методу (А), т.к. он легче воздуха и очень хорошо растворим в воде.
Химические свойства
Образование ковалентной связи по донорно-акцепторному механизму.
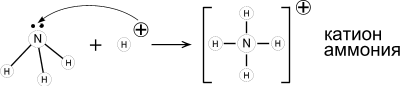
- Аммиак — основание Льюиса. Его раствор в воде (аммиачная вода, нашатырный спирт) имеет щелочную реакцию (лакмус – синий; фенолфталеин – малиновый) из-за образования гидроксида аммония. NH3 + Н2O = NH4OH = NH4+ + OH—
- Аммиак реагирует с кислотами с образованием солей аммония.
NH3 + HCl = NH4Cl
2NH3 + H2SO4 = (NH4)2SO4
NH3 + H2O + CO2 = NH4HCO3
Аммиак — восстановитель (окисляется до N2+1O или N+2O)
- Разложение при нагревании
2N-3H3 = N20 + 3H2
2. Горение в кислороде
а) без катализатора
4N-3H3 + 3O2 = 2N20 + 6Н2O
б) каталитическое окисление ( kat = Pt )
4N-3H3 + 5O2 = 4N+2O + 6Н2O
3. Восстановление оксидов некоторых металлов
3Cu+2O + 2N-3H3 = 3Cu0 + N20 + 3Н2O
ПОДГРУППА АЗОТА
СОЛИ АММОНИЯ
Соли аммония – сложные вещества, в состав которых входят катионы аммония NH4+, связанные с кислотным остатком.
Физические свойства
Кристаллические вещества, хорошо растворимые в воде.
Получение
Аммиак (или гидроксид аммония) + кислота.
NH3 + HNO3 = NH4NO3(нитрат аммония)
2NH4OH + H2SO4 = (NH4)2SO4(cульфат аммония) + 2Н2O
Химические свойства
- Сильные электролиты (диссоциируют в водных растворах)
NH4Cl = NH4+ + Cl—
2. Разложение при нагревании.
а) если кислота летучая
NH4Cl = NH3 + HCl
NH4HCO3 = NH3 + Н2O + CO2
б) если анион проявляет окислительные свойства
NH4NO3 = N2O + 2Н2O
(NH4)2Cr2O7 = N2 + Cr2O3 + 4Н2O
3. С кислотами и солями (реакция обмена)
а) (NH4)2CO3 + 2НCl = 2NH4Cl + Н2O + CO2
2NH4++ CO32- + 2H+ + 2Cl— = 2NH4+ + 2Cl— + Н2O + CO2
CO32- + 2H+ = Н2O + CO2
б) (NH4)2SO4 + Ba(NO3)2 = BaSO4¯ + 2NH4NO3
2NH4+ + SO42- + Ba2+ + 2NO3— = BaSO4¯ + 2NH4+ + 2NO3—
Ba2+ + SO42- = BaSO4¯
4. Соли аммония подвергаются гидролизу (как соль слабого основания и сильной кислоты) – среда кислая:
NH4Cl + Н2O = NH4OH + HCl
NH4+ + Н2O = NH4OH + H+
5. При нагревании со щелочами выделяют аммиак (качественная реакция на NH4+)
NH4Cl + NaOH = NaCl + NH3 + Н2O
ПОДГРУППА АЗОТА
ОКСИДЫ АЗОТА
ОКСИД АЗОТА (I)
ЗАКИСЬ АЗОТА, «ВЕСЕЛЯЩИЙ ГАЗ»
ОКСИД АЗОТА (II)
ОКИСЬ АЗОТА
ОКСИД АЗОТА (III)
АЗОТИСТЫЙ АНГИДРИД
ОКСИД АЗОТА (IV)
ДВУОКИСЬ АЗОТА, ДИОКСИД АЗОТА
ОКСИД АЗОТА (V)
АЗОТНЫЙ АНГИДРИД
Оксид азота (I)
N2+1O закись азота, «веселящий газ»
Физические свойства
Газ, бесцветный, запах сладковатый, растворим в воде, t°пл.= -91°C, t°кип.= -88,5°С. Анестезирующее средство.
Получение
NH4NO3 –t° > N2O + 2Н2O
Химические свойства
- Разлагается при 700°C с выделением кислорода:
2N2+1O = 2N20 + O20
поэтому он поддерживает горение и является окислителем
2. С водородом:
N2+1O + H2 = N20 + Н2O
3. Несолеобразующий
Оксид азота (II)
N+2O окись азота
Газ, бесцветный, плохо растворим в воде, t°пл.= -164°C, t°кип.= -152°С
Получение
- Каталитическое окисление аммиака (промышленный способ)
4NH3 +5O2 = 4NO + 6H2O
2. 3Cu + 8HNO3(разб.) = 3Cu(NO3)2 + 2NO + 4H2O
3. N2 + O2 = 2NO (в природе, во время грозы)
Химические свойства
- Легко окисляется кислородом и галогенами
2NO + O2 = 2NO2
2NO + Cl2 = 2NOCl(хлористый нитрозил)
2. Окислитель
2N+2O + 2S+4O2 = 2S+6O3 + N20
3. Несолеобразующий
Оксид азота (III)
N2+3O3 азотистный ангидрид
Физические свойства
Темно-синяя жидкость (при низких температурах), t°пл.= -102°C, t°кип.= 3,5°С; Выше t°кип. разлагается на NO и NO2. N2O3 соответствует азотистой кислоте (HNO2), которая существует только в разбавленных водных растворах.
Получение
NO2 + NO = N2O3
Химические свойства
Все свойства кислотных оксидов.
N2O3 + 2NaOH = 2NaNO2(нитрит натрия) + H2O
Оксид азота (IV)
N+4O2 двуокись азота, диоксид азота
Физические свойства
Бурый газ, запах резкий, удушливый, ядовит, t°пл.= -11,2°C, t°кип.= 21°С.
Получение
- 2NO + O2 = 2NO2
2. Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2 + 2H2O
Химические свойства
- Кислотный оксид
с водой
2NO2 + H2O = HNO3 + HNO2
4NO2 + 2H2O + O2 = 4HNO3
со щелочами
2NO2 + 2NaOH = NaNO2 + NaNO3 + H2O
2. Окислитель
N+4O2 + S+4O2 = S+6O3 + N+2O
3. Димеризация
2NO2(бурый газ) = N2O4(бесцветная жидкость)
Оксид азота (V)
N2+5O5 азотный ангидрид
Физические свойства
Кристаллическое вещество, летучее, неустойчивое.
Получение
- 2NO2 + O3 = N2O5 + O2
2. 2HNO3 +P2O5 = 2HPO3 + N2O5
Химические свойства
- Кислотный оксид
N2O5 + H2O = 2HNO3
2. Сильный окислитель
3. Легко разлагается (при нагревании — со взрывом):
2N2O5 -> 4NO2 + O2
ПОДГРУППА АЗОТА
АЗОТИСТАЯ КИСЛОТА
HNO2 Азотистая кислота
H–O–N=O
Физические свойства
Существует только в разбавленных водных растворах.
Получение
AgNO2 + HCl = HNO2 + AgCl¯
Химические свойства
- Слабая кислота; ее соли (нитриты) – устойчивы:
HNO2 + NaOH = NaNO2 + H2O
2. Разлагается при нагревании:
3HNO2 = HNO3 + 2NO + H2O
3. Слабый окислитель (окислительные свойства проявляет только в реакциях с сильными восстановителями)
2KNO2 + 2KI + 2H2SO4 = 2K2SO4 + I2 + 2NO + 2H2O
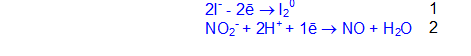
2I— + 2NO2— + 4H+ = I20 + 2NO + 2H2O
4. Сильный восстановитель:
HNO2 + Cl2 + H2O = HNO3 + 2HCl
ПОДГРУППА АЗОТА
АЗОТНАЯ КИСЛОТА
HNO3 Азотная кислота
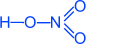
Физические свойства
Бесцветная жидкость, неограниченно растворимая в воде; t°пл.= -41°C; t°кип.= 82,6°С, r = 1,52 г/см3
Получение
- Лабораторный способ
KNO3 + H2SO4(конц) = KHSO4 + HNO3
2. Промышленный способ.
Осуществляется в три этапа:
- Окисление аммиака на платиновом катализаторе до NO
4NH3 + 5O2 = 4NO + 6H2O
2. Окисление кислородом воздуха NO до NO2
2NO + O2 = 2NO2
3. Поглощение NO2 водой в присутствии избытка кислорода
4NO2 + О2 + 2H2O = 4HNO3
Химические свойства
Очень сильная кислота. Диссоциирует в водном растворе практически нацело:
HNO3 = H+ + NO3—
Реагирует:
с основными оксидами
CuO + 2HNO3 = Cu(NO3)2 + H2O
CuO + 2H+ + 2NO3— = Cu2+ + 2NO3— + H2O
или CuO + 2H+ = Cu2+ + H2O
с основаниями
HNO3 + NaOH = NaNO3 + H2O
H+ + NO3— + Na+ + OH— = Na+ + NO3— + H2O
или H+ + OH— = H2O
вытесняет слабые кислоты из их солей
2HNO3 + Na2CO3 = 2NaNO3 + H2O + CO2
2H+ + 2NO3— + 2Na+ + СO32- = 2Na+ + 2NO3— + H2O + CO2
2H+ + СO32- = H2O + CO2
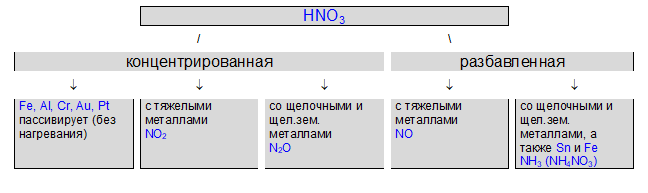
Специфические свойства азотной кислоты
Сильный окислитель
- Разлагается на свету и при нагревании
4HNO3 = 2H2O + 4NO2 + O2
2. Окрашивает белки в оранжево-желтый цвет (при попадании на кожу рук — «ксантопротеиновая реакция»)
3. При взаимодействии с металлами никогда не выделяется водород
металл + HNO3 = соль азотной кислоты + вода + газ
HNO3 + 4HCl + Au -> H[AuCl4] + NO + 2H2O
«царская водка»
(1:3 по объему)
4. С неметаллами:
Азотная кислота превращается в NO (или в NO2); неметаллы окисляются до соответствующих кислот:
S0 + 6HNO3(конц) = H2S+6O4 + 6NO2 + 2H2O
B0 + 3HNO3 = H3B+3O3 + 3NO2
3P0 + 5HNO3 + 2H2O = 5NO + 3H3P+5O4
Применение
В промышленности азот извлекают из воздуха путём его глубокого охлаждения до жидкого состояния с последующим разделением, например, методом ректификации. Основная область использования азота – синтез аммиака с последующим получением из него азотной кислоты, удобрений и многих других веществ, содержащих связанный азот. Свободный азот применяют как инертную среду в химических и металлургических процессах, при перекачке горючих жидкостей и др.; жидкий азот – хладагент. Газообразный азот хранят и транспортируют в сжатом виде в стальных баллонах, жидкий азот – в сосудах Дьюара.
Задачи:
1. Азот находится в сосуде вместимостью 20 л при давлении 380 кПа и температуре 27 °С. Вычислите массу азота, находящегося в сосуде.
2. Вычислите объем азота (нормальные условия), который может прореагировать с магнием массой 3 г.
3. Азот объемом 56 л (нормальные условия) прореагировал с водородом (водород в избытке). Массовая доля выхода аммиака составила 50 %. Рассчитайте массу полученного аммиака.
4. Рассчитайте массовую долю азота в следующих веществах: N2O, NO2, Cu(NO3)2 и NH4NO2. В каком соединении массовая доля азота самая большая,
5. Аммиак объемом 20 л растворили в воде массой 400 г (объем газа приведен к нормальным условиям). Определите массовую долю аммиака в полученном растворе.
6. Рассчитайте массу аммиака, который потребуется для получения азотной кислоты массой 3,15 т.
При расчете учтите, что производственные потери веществ составляют 15%.