Ионное произведение воды
Вода является слабым электролитом и в незначительной степени диссоциирует на ионы по реакции:
H2O ⇄ H+ + OH—
K = ([H+][OH—]) / [H2O] = 1,8 • 10-16 (при 22°С)
В знаменателе дроби — концентрация недиссоциированных молекул воды, которую можно считать постоянной и определить в 1 л, приняв массу 1 л воды за 1000 г.
[H2O] = 1000 / 18 = 55,56 молей
Тогда
K = ([H+][OH—]) / 55,56 = 1,8 • 10-16
или ([H+][OH —] = 1 • 10-14 (ионное произведение воды)
pH раствора
Величина pH используется для характеристики кислотности раствора.
Если концентрация ионов водорода равна [H+], то
pH = -lg [H+]
В чистой воде
[H+] = [OH—] = 10-7 pH = — lg 10-7 = 7
В кислых растворах
[H+] > [OH—] и pH < 7
например, в 10-3 М растворе HCl
pH = 3
В щелочных растворах
[H+] < [OH—] и pH > 7
например, в 10-2 М растворе NaOH
pOH = -lg2 • 10-2 = 2 — lg2 = 1,7
pH = 14 — pOH = 14 — 1,7 = 12,3
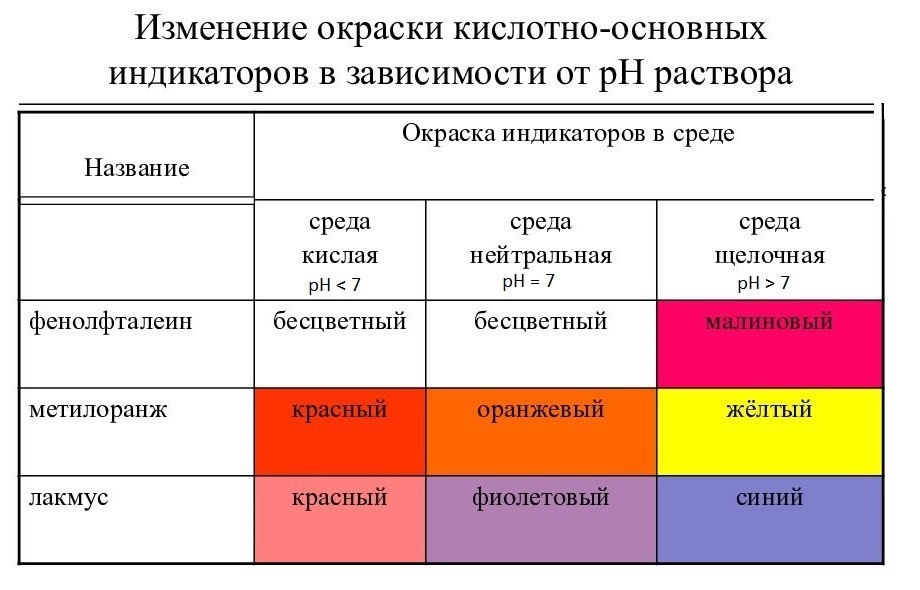
Таблица. Изменение окраски кислотно-основных индикаторов в зависимости от pH раствора
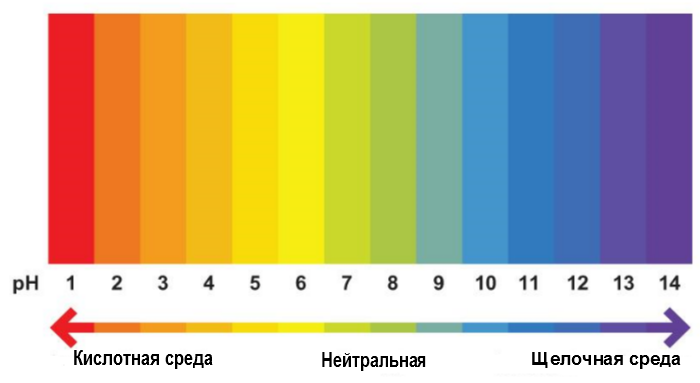
Для более точного определения значения pH растворов используют сложную смесь нескольких индикаторов, нанесенную на фильтровальную бумагу (так называемый «Универсальный индикатор Кольтгоффа»). Полоску индикаторной бумаги обмакивают в исследуемый раствор, кладут на белую непромокаемую подложку и быстро сравнивают окраску полоски с эталонной шкалой для pH:
Определение гидролиза
Гидролиз — это химическая реакция ионного обмена между водой и растворённым в ней веществом с образованием слабого электролита. (В общем случае обменное взаимодействие растворённого вещества с растворителем носит название — сольволиз).
В большинстве случаев гидролиз сопровождается изменением pH раствора.
Большинство реакций гидролиза — обратимы:
Pb(NO3)2 + H2O ⇆ Pb(OH)(NO3) + HNO3
Na3PO4 + H2O ⇆ Na2HPO4 + NaOH
Некоторые реакции гидролиза протекают необратимо:
Al2S3 + 6H2O ⇆ 2Al(OH)3 + 3H2S
Причиной гидролиза является взаимодействие ионов соли с молекулами воды из гидратной оболочки с образованием малодиссоциированных соединений или ионов.
Способность солей подвергаться гидролизу зависит от двух факторов:
- свойств ионов, образующих соль;
- внешних факторов.
Отсутствие гидролиза в растворах
Соли, образованные катионом сильного основания и анионом сильной кислоты (например, LiBr, K2SO4, NaClO4, BaCl , Ca(NO3)2 и др.) гидролизу не подвергаются, т.к. ни катион, ни анион соли не могут при взаимодействии с водой образовать молекулы слабых электролитов. Водные растворы таких солей имеют нейтральную реакцию среды (pH = 7). Практически не гидролизуются также и труднорастворимые соли (CaCO3, Mg3(PO4)2 и др.) из-за очень низкой концентрации ионов в водных растворах этих солей.
Гидролиз по катиону
Соли слабого основания и сильной кислоты гидролизуются по катиону:
Гидролиз солей, образованных многовалентным катионом протекает ступенчато, через стадии образования основных солей:
1 ступень:
Al(NO3)3 + H2O ⇆ Al(OH)(NO3)2 + HNO3
Al3+ + H2O ⇆ [Al(OH)]2+ + H+
2 ступень:
Al(OH)(NO3)2 + H2O ⇆ Al(OH)2(NO3) + HNO3
[Al(OH)]2+ + H2O ⇆ [Al(OH)2]+ + H+
3 ступень:
Al(OH)2(NO3) + H2O ⇆ Al(OH)3 + HNO3
[Al(OH)2]+ + H2O ⇆ Al(OH)3 + H+
Гидролиз протекает достаточно сильно по первой ступени, слабо — по второй ступени и совсем слабо — по третьей ступени (ввиду накопления ионов водорода, процесс смещается в сторону исходных веществ). Более полному гидролизу способствует разбавление раствора и повышение температуры. (В этом случае можно учитывать гидролиз и по третьей ступени.)
При гидролизе по катиону реакция раствора кислая pH < 7.
Гидролиз по аниону
Соли, образованные сильным основанием и слабой кислотой гидролизуются по аниону:
K2CO3 + H2O ⇆ KHCO3 + KOH
В полной ионной форме:
2K+ + CO32- + H2O ⇆ K+ +HCO3— + K++ OH—
В сокращенной ионной форме:
CO32- + H2O ⇆ HCO3— + OH—
Задания
Записать уравнения гидролиза в молекулярной, ионной и сокращенной ионной форме для следующих солей:
а) FeBr3
б) K2SiO3
в) SnCl2
г) K3PO4