Теория электролитической диссоциации
- При растворении в воде (или расплавлении) электролиты распадаются на положительно и отрицательно заряженные ионы (подвергаются электролитической диссоциации).
- Под действием электрического тока катионы (+) движутся к катоду (-), а анионы (-) – к аноду (+).
- Электролитическая диссоциация — процесс обратимый (обратная реакция называется моляризацией).
- Степень электролитической диссоциации (α) зависит от природы электролита и растворителя, температуры и концентрации.
Степень электролитической диссоциации показывает отношение числа молекул, распавшихся на ионы (Nдисс.) к общему числу молекул (N0).
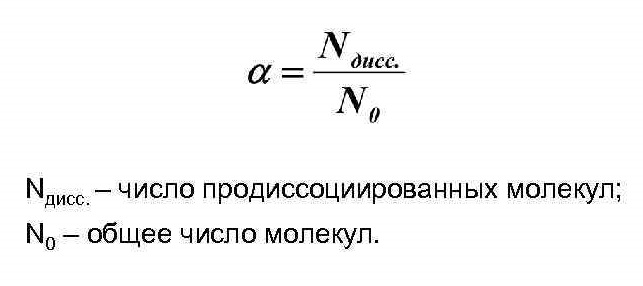
Механизм электролитической диссоциации ионных веществ
При растворении соединений с ионными связями (например, NaCl) процесс гидратации начинается с ориентации диполей воды вокруг всех выступов и граней кристаллов соли.
Ориентируясь вокруг ионов кристаллической решетки, молекулы воды образуют с ними либо водородные, либо донорно-акцепторные связи. При этом процессе выделяется большое количество энергии, которая называется энергией гидратации.
Энергия гидратации, величина которой сравнима с энергией кристаллической решетки, идет на разрушение кристаллической решетки. При этом гидратированные ионы слой за слоем переходят в растворитель и, перемешиваясь с его молекулами, образуют раствор.
Электролиты и неэлектролиты
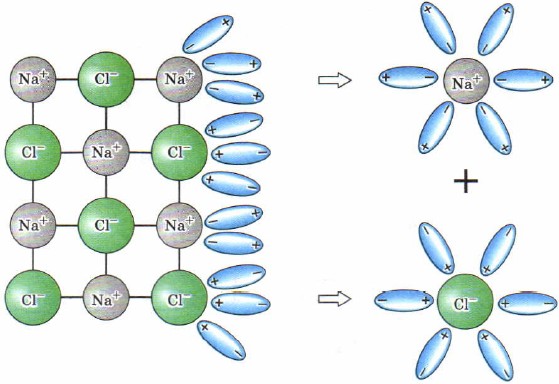
Электролитическая диссоциация веществ, идущая с образованием свободных ионов объясняет электрическую проводимость растворов.
Процесс электролитической диссоциации принято записывать в виде схемы, не раскрывая его механизма и опуская растворитель (H2O), хотя он является основным участником.
CaCl2 <=> Ca2++ 2Cl—
KAl(SO4)2 <=> K+ + Al3+ + 2SO42-
HNO3 <=> H+ + NO3—
Ba(OH)2 <=> Ba2+ + 2OH—
Из электронейтральности молекул вытекает, что суммарный заряд катионов и анионов должен быть равен нулю.
Например, для
Al2(SO4)3 –– 2 • (+3) + 3 • (-2) = +6 — 6 = 0
KCr(SO4)2 –– 1 • (+1) + 3 • (+3) + 2 • (-2) = +1 + 3 — 4 = 0
Сильные электролиты
Это вещества, которые при растворении в воде практически полностью распадаются на ионы. Как правило, к сильным электролитам относятся вещества с ионными или сильно полярными связями:
1. все хорошо растворимые соли,(NaCl, KF, NaNO3, BaSO4 )
2. сильные кислоты (HCl, HBr, HI, HClO4, H2SO4,HNO3)
3. сильные основания (LiOH, NaOH, KOH, RbOH, CsOH, Ba(OH)2,Sr(OH)2,Ca(OH)2).
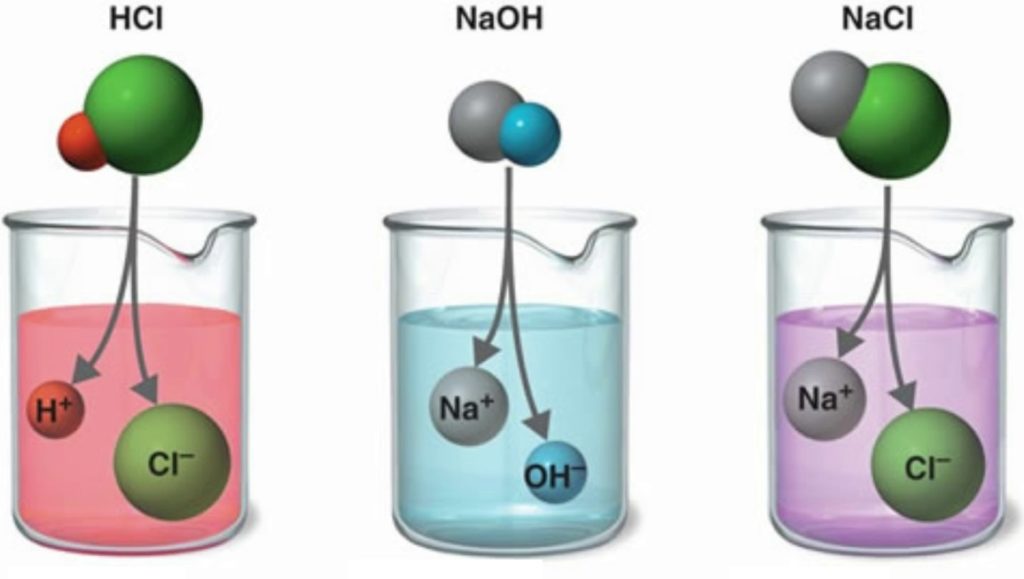
В растворе сильного электролита растворённое вещество находится в основном в виде ионов (катионов и анионов); недиссоциированные молекулы практически отсутствуют.
Слабые электролиты
Вещества, частично диссоциирующие на ионы. Растворы слабых электролитов наряду с ионами содержат недиссоциированные молекулы. Слабые электролиты не могут дать большой концентрации ионов в растворе.
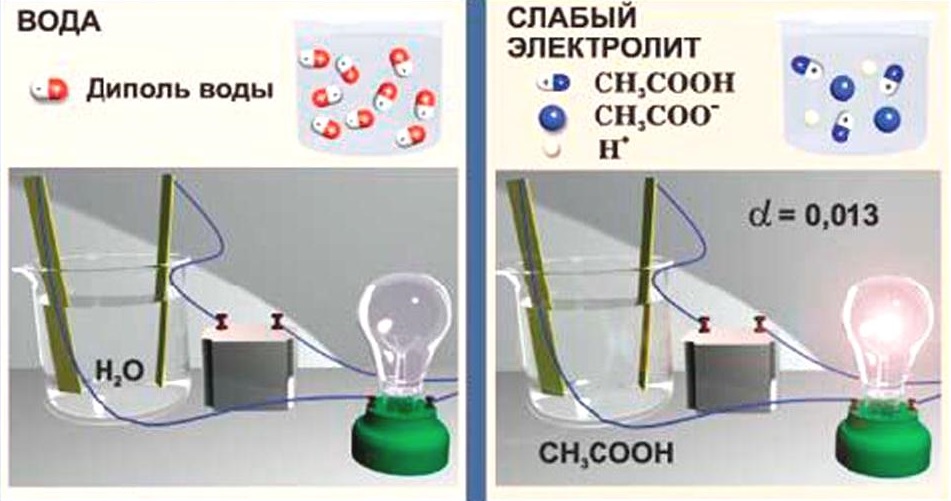
К слабым электролитам относятся:
- почти все органические кислоты (CH3COOH, C2H5COOH и др.);
- некоторые неорганические кислоты (H2CO3, H2S и др.);
- почти все малорастворимые в воде соли, основания и гидроксид аммония (Ca3(PO4)2; Cu(OH)2; Al(OH)3; NH4OH);
- вода.
Они плохо (или почти не проводят) электрический ток.
СH3COOH ⇄ CH3COO— + H+
Cu(OH)2 ⇄ [CuOH]+ + OH— (первая ступень)
[CuOH]+ ⇄ Cu2+ + OH— (вторая ступень)
H2CO3 ⇄ H+ + HCO— (первая ступень)
HCO3— ⇄ H+ + CO32- (вторая ступень)
Неэлектролиты
Вещества, водные растворы и расплавы которых не проводят электрический ток. Они содержат ковалентные неполярные или малополярные связи, которые не распадаются на ионы.
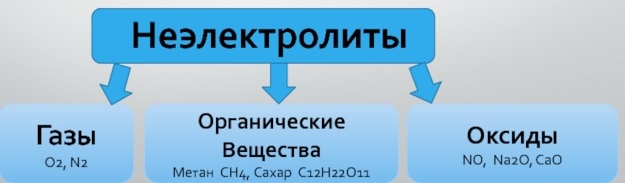
Электрический ток не проводят газы, твердые вещества (неметаллы), некоторые органические соединения (сахароза, бензин, спирт…).
Константа диссоциации
Концентрация ионов в растворах зависит от того, насколько полно данный электролит диссоциирует на ионы. В растворах сильных электролитов, диссоциацию которых можно считать полной, концентрацию ионов легко определить по концентрации (c) и составу молекулы электролита (стехиометрическим индексам), например:
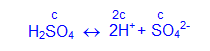
Концентрации ионов в растворах слабых электролитов качественно характеризуют степенью и константой диссоциации.
Константа диссоциации вычисляется как отношение произведения молярных концентраций ионов к общей концентрации молекул.
Запишем константу диссоциации для следующего уравнения диссоциации:
Ba(OH)2 ⇄ Ba2+ + 2OH—
[Ba2+] — молярная концентрация ионов Ba2+
[OH—] — молярная концентрация ионов OH—
[Ba(OH)2] — молярная концентрация молекул Ba(OH)2
Тогда константа диссоциации:
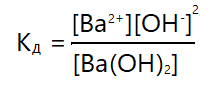
Задание:
Записать уравнения диссоциации:
- Сернистой кислоты
- Гидроксида кальция
- Сульфата алюминия
- Фосфата бария