Фосфор (P) — открыт алхимиком Х. Брандом в 1669 году. В свободном состоянии в природе не встречается.
Электронная конфигурация 1S22S22P63S23P3
Важнейшие аллотропные модификации
Белый фосфор. Получается при конденсации паров. Состоит из молекул P4. Мягкое, бесцветное вещество, ядовит, имеет чесночный запах, t°пл.= 44°С, t°кип.= 280°С, растворим в сероуглероде (CS2), летуч. Очень реакционноспособен, окисляется на воздухе (при этом самовоспламеняется), в темноте светится.

Красный фосфор. Без запаха, цвет красно-бурый, не ядовит. Атомная кристаллическая решётка очень сложная, обычно аморфен. Нерастворим в воде и в органических растворителях. Устойчив. В темноте не светится. Физические свойства зависят от способа получения.

Чёрный фосфор — полимерное вещество с металлическим блеском, похож на графит, без запаха, жирный на ощупь. Нерастворим в воде и в органических растворителях. Атомная кристаллическая решётка, полупроводник. t°кип.= 453°С (возгонка), t°пл.= 1000°C (при p=1,8 • 109 Па), устойчив.

Получение
Красный и черный фосфор получают из белого. Белый фосфор получают восстановлением фосфата кальция (сплавление в электрической печи):
Ca3(PO4)2 + 3SiO2 + 5C = 3CaSiO3 + 5CO + 2P
Химические свойства.
- Реакции с кислородом:
4P0 + 5O2 = 2P2+5O5
(при недостатке кислорода: 4P0 + 3O2 = 2P2+3O3)
2. С галогенами и серой:
2P + 3Cl2 = 2PCl3
2P + 5Cl2 = 2PCl5
2P + 5S = P2S5
(галогениды фосфора легко разлагаются водой, например:
PCl3 + 3H2O = H3PO3 + 3HCl
PCl5 + 4H2O = H3PO4 + 5HCl)
3. С азотной кислотой:
3P0 + 5HN+5O3 + 2H2O = 3H3P+5O4 + 5N+2O
4. С металлами образует фосфиды, в которых фосфор проявляет степень окисления — 3:
2P0 + 3Mg = Mg3P2-3
(фосфид магния легко разлагается водой
Mg3P2 + 6H2O = 3Mg(OH)2 + 2PH3(фосфин))
3Li + P = Li3P-3
5. Со щелочью:
4P + 3NaOH + 3H2O = PH3 + 3NaH2PO2
В реакциях (1,2,3) — фосфор выступает как восстановитель, в реакции (4) — как окислитель; реакция (5) — пример реакции диспропорционирования.
Соединения фосфора
P-3H3 Фосфин – газ, с неприятным запахом тухлой рыбы, бесцветный, малорастворим в воде, нестоек, ядовит; t°пл.= -87,5°С, t°кип.= -134°С.
Получение
Фосфиды щелочных и щелочноземельных металлов разлагаются водой и кислотами с образованием фосфина:
Ca3P2 + 6HCl = 3CaCl2 + 2PH3
Ca3P2-3 + 6H2O = 3Ca(OH)2+ 2P-3H3
Химические свойства.
- Разлагается при нагревании:
2PH3 = 2P + 3H2
2. Проявляет слабые основные свойства:
PH3 + HI = [PH4]+I—
йодистый фосфоний менее устойчивый, чем соли аммония.
3. Сильный восстановитель. На воздухе самовоспламеняется.
P2+3 O3 Фосфористый ангидрид (оксид фосфора (III)).
Белые кристаллы, t°пл.= 24°С; t°кип.= 175°C. Существует в виде нескольких модификаций. В парах состоит из молекул P4O6. P2O3 соответствует фосфористая кислота H3PO3.
Получение
Окисление фосфора при недостатке кислорода
4P + 3O2 = 2P2O3
Химические свойства
- Все свойства кислотных оксидов.
P2O3 + 3H2O = 2H3PO3
2. Сильный восстановитель
O2+ P2+3O3 = P2+5O5
P2+5O5 Фосфорный ангидрид (оксид фосфора (V)).
Белые кристаллы, t°пл.= 570°С, t°кип.= 600°C, r = 2,7 г/см3. Имеет несколько модификаций. В парах состоит из молекул P4H10, очень гигроскопичен (используется как осушитель газов и жидкостей).
Получение
4P + 5O2 = 2P2O5
Химические свойства
Все химические свойства кислотных оксидов: реагирует с водой, основными оксидами и щелочами
P2O5 + H2O = 2HPO3(метафосфорная кислота)
P2O5 + 2H2O = H4P2O7(пирофосфорная кислота)
P2O5 + 3H2O = 2H3PO4(ортофосфорная кислота)
2.
P2O5 + 3BaO = Ba3(PO4)2
3.
P2O5 + 6KOH = 2K3PO4+ 3H2O
P2O5 — сильное водоотнимающее средство:
4..
P2O5+ 2HNO3 = 2HPO3 + N2O5
P2O5+ 2HClO4 = 2HPO3+ Cl2O7
HP+5O3 Метафосфорная кислота.
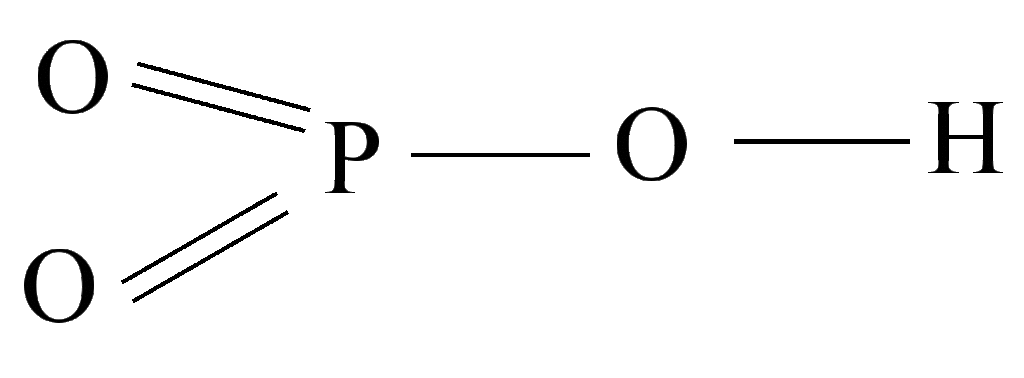
Получение
P2O5+ H2O = 2HPO3
Соли метафосфорной кислоты — метафосфаты (KPO3 – метафосфат калия)
Химические свойства
Характерны все свойства кислот.
H3P+5O3 Фосфористая кислота
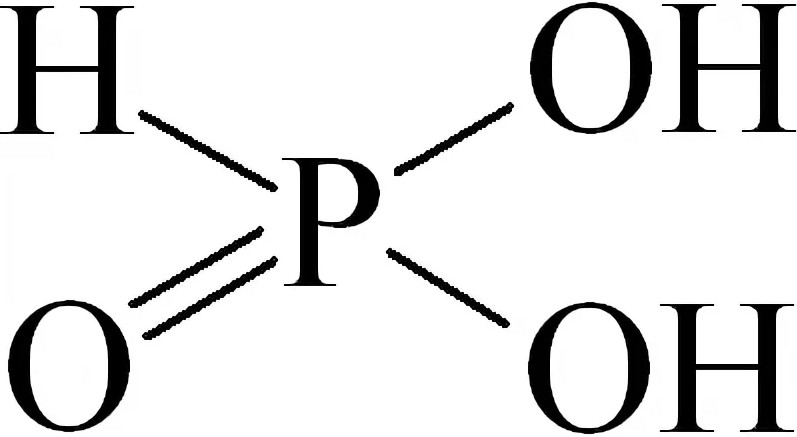
Бесцветное кристаллическое вещество; t°пл.= 74°С, хорошо растворимое в воде.
Получение
PCl3+ 3H2O = H3PO3+ 3HCl
Химические свойства
- Водный раствор H3PO3 — двухосновная кислота средней силы (соли – фосфиты):
H3PO3+ 2NaOH = Na2HPO3+ 2H2O
2. При нагревании происходит превращение в ортофосфорную кислоту и фосфин:
4H3PO3 = 3H3PO4+ PH3
3. Восстановительные свойства:
H3PO3+ HgCl2+ H2O = H3PO4+ Hg + 2HCl
H3P+5O4 Ортофосфорная кислота.
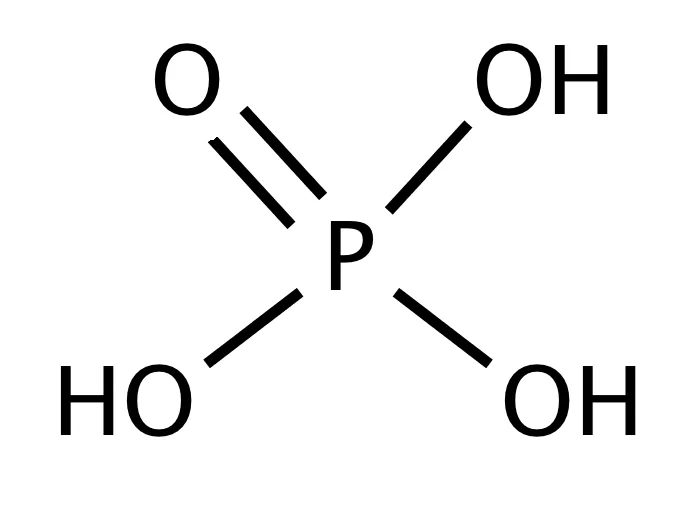
Белое твердое вещество, гигроскопичное, хорошо растворимое в воде; t°пл.= 42°С, r = 1,88 г/см3.
Диссоциация:
H3PO4 = 3H+ + PO4-3
H3PO4+ 3H2O = 3H3O+ + PO43-
H3PO4 = H+ + H2PO4—
H2PO4— = H+ + HPO42-
HPO42- = H+ + PO43-
Ортофосфорная кислота — средней силы, не является окислителем, трехосновная. Она образует средние соли — ортофосфаты (Na3PO4) и два типа кислых солей — дигидрофосфаты (NaH2PO4) и гидрофосфаты (Na2HPO4).
Получение
P2O5+ 3H2O = 2H3PO4
Промышленный способ:
2.
Ca3(PO4)2(твердый) + 3H2SO4(конц.) = 2H3PO4+ 3CaSO4
3.
3P + 5HNO3+ 2H2O = 3H3PO4+ 5NO
Химические свойства
Для ортофосфорной кислоты характерны все свойства кислот – неокислителей. При нагревании она превращается в пирофосфорную кислоту.
2H3PO4 = H4P2O7 + H2O
Качественная реакция на обнаружение в растворе анионов PO43-
3Ag+ + PO43- = Ag3PO4¯(ярко-желтый осадок)
Фосфорные удобрения

Фосфорными удобрениями являются кальциевые и аммонийные соли фосфорной кислоты.
Фосфоритная мука
Получают при тонком размоле фосфоритов. Так как она содержит нерастворимую соль Ca3(PO4)2, то усваиваться растениями может только на кислых почвах.
При обработке фосфоритов или аппатитов серной или фосфорной кислотой получают растворимые в воде соединения, хорошо усваемые растениями на любых почвах:
Ca3(PO4)2 + 2H2SO4 = Ca(H2PO4)2 + 2CaSO4
(Ca(H2PO4)2 простой суперфосфат (обычно применяют в виде гранул Æ 2-4 мм))
Ca3(PO4)2 + 4H3PO4 = 3Ca(H2PO4)2(двойной суперфосфат)
Нейтрализацией гашеной извести фосфорной кислотой получают преципитат:
H3PO4 + Ca(OH)2 = CaHPO4 • 2H2O
Нейтрализацией фосфорной кислоты аммиаком получают аммофос – (NH4)2HPO4 + NH4H2PO4, содержащий N и P. Разновидности: нитроаммофос – NH4H2PO4 + NH4NO3; аммофоска – (NH4)2HPO4 + NH4H2PO4 + KCl.
Применение
Основную долю всего добываемого фосфора (90 %) используют для получения оксида и фосфорной кислоты, применяемой в производстве фосфорных удобрений и фосфатов, в том числе минеральных подкормок для животноводства. Фосфор – сырьё в производстве неорганических и органических фосфорсодержащих соединений. Белый фосфор применяют в качестве дымообразующего и зажигательного средства, для изготовления трассирующих боеприпасов; красный фосфор – основной компонент обмазки зажигательной поверхности спичечных коробков в спичечной промышленности, компонент термопластичных композиций, газопоглотитель в производстве ламп накаливания. В металлургии фосфор – раскислитель при получении некоторых сплавов, легирующая добавка и др. Фосфор высокой чистоты используют для получения полупроводниковых фосфидов. Искусственный радионуклид 32P (период полураспада T1/2 14,26 суток, β-излучатель) применяют в исследовании механизмов реакций и в качестве радиоактивной метки.
Белый фосфор высокотоксичен. Симптомы острого отравления: желудочно-кишечные расстройства, сердечная недостаточность. При хроническом отравлении происходит поражение костей. Попадая на кожу, белый фосфор воспламеняется и даёт тяжёлые ожоги. Хранят белый фосфор под слоем воды в темноте. Красный фосфор менее токсичен, но его пыль может вызывать хроническое отравление, пневмонию, поражение кожи. Чёрный фосфор нетоксичен.
Задачи:
- Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения:
P → P205 → H3PO4→ Na3PO4→ Са3(PO4)2 - Определите массовую долю оксида фосфора (V) в преципитате СаНPO4 ·2H2O.
- В суперфосфате массовая доля оксида фосфора (V) составляет 25%. Рассчитайте массовую долю Ca(H2PO4), в этом удобрении.
- Определите массу раствора фосфорной кислоты (массовая доля H3PO4 25%), который можно получить, используя фосфорит массой 20 кг. Массовая доля Са3(РО4), в фосфорите равна 93%.
- При помощи каких реакций можно осуществить следующие превращения:
P → Сa3P2 → РН3 → P205 → K3PO4 → Са3(PO4)2
Напишите уравнения этих реакций. - Методом электронного баланса подберите коэффициенты в схемах следующих окислительно-восстановительных реакций:
a) PH3 + O2 → P205 + H2O
6) Fe + HNO3 → Fe(NO3)3 + NH4NO3+H2O
B) Mg + HNO3 → Mg(NO3)2 +N20 + H20
г) Cs,(РО4)2 + C + SiO2 -+ CaSiO3 + P + CO