
Химия — наука о веществах, физических и химических свойствах, закономерностях превращений и применении.
Химические явления — это процессы, при которых одни вещества превращаются в другие, отличающиеся от исходных составом и свойствами, при этом состав ядер атомов не изменяется.
Физические явления — это процессы, сопровождающиеся изменением физического состояния веществ (парообразование, плавление, электропроводность, выделение тепла и света, ковкость и др.) или при этом образуются новые вещества с изменением состава ядер атомов.
Атомно — молекулярное учение.
- Все вещества состоят из молекул.
- Молекулы состоят из атомов.
- Молекулы и атомы находятся в непрерывном движении; между ними существуют силы притяжения и отталкивания.
Молекула — наименьшая частица вещества, обладающая его химическими свойствами.
Атом — наименьшая частица химического элемента, сохраняющая все его химические свойства. Различным элементам соответствуют различные атомы.
Химический элемент — это вид атомов, характеризующийся определенным зарядом ядра и строением электронной оболочки.
В настоящее время известно 117 элементов: 89 из них найдены в природе (на Земле), остальные получены искусственным путем. Атомы существуют в свободном состоянии, в соединениях с атомами того же или других элементов, образуя молекулы. Способность атомов вступать во взаимодействие с другими атомами и образовывать химические соединения определяется его строением. Атомы состоят из положительно заряженного ядра и отрицательно заряженных электронов, движущихся вокруг него, образуя электронейтральную систему, которая подчиняется законам, характерным для микросистем.
Атомное ядро — центральная часть атома, состоящая из Z протонов и N нейтронов, в которой сосредоточена основная масса атома.
Заряд ядра — положительный, по величине равен количеству протонов в ядре или электронов в нейтральном атоме и совпадает с порядковым номером элемента в периодической системе.
Массовое число — сумма протонов и нейтронов атомного ядра A = Z + N.
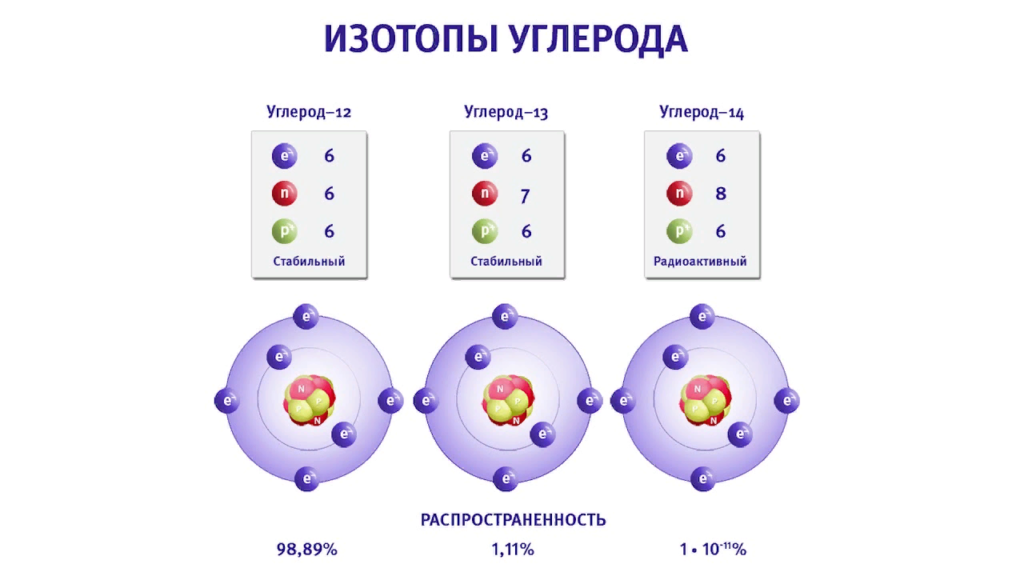
Изотопы — химические элементы с одинаковыми зарядами ядер, но различными массовыми числами за счет разного числа нейтронов.
Химическая формула — это условная запись состава вещества с помощью химических знаков (предложены в 1814 г. Й. Берцелиусом) и индексов (индекс — цифра, стоящая справа внизу от символа. Обозначает число атомов в молекуле).
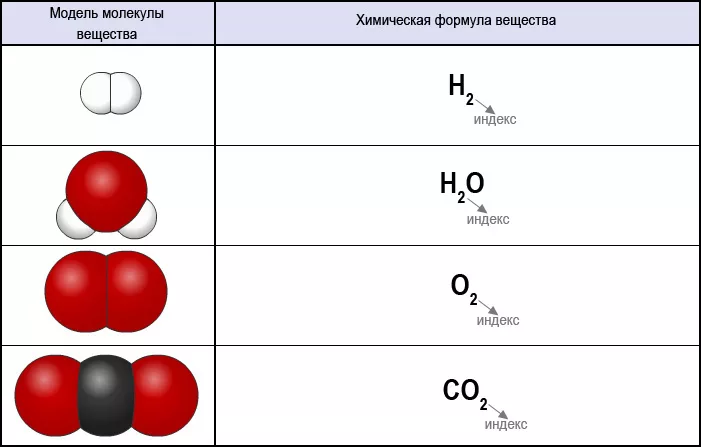
Химическая формула показывает, атомы каких элементов и в каком отношении соединены между собой в молекуле.
Простые вещества — это вещества, молекулы которых состоят из атомов одного элемента.

Cложные вещества – это вещества, молекулы которых состоят из атомов различных химических элементов.
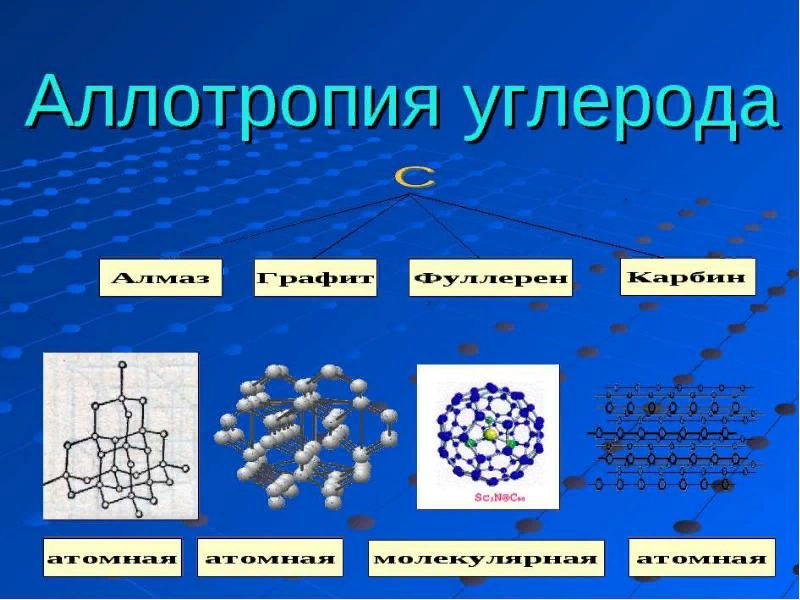
Аллотропия — явление образования химическим элементом нескольких простых веществ, различающихся по строению и свойствам.
Международная единица атомных масс равна 1/12 массы атома изотопа 12C — основного изотопа природного углерода.
1 а.е.м = 1/12 • m (12C) = 1,66057 • 10-24 г
Относительная атомная масса (Ar) — безразмерная величина, равная отношению средней массы атома элемента (с учетом процентного содержания изотопов в природе) к 1/12 массы атома 12C.
Средняя абсолютная масса атома (m) равна относительной атомной массе, умноженной на а.е.м.
Ar(Mg) = 24,312
m (Mg) = 24,312 • 1,66057 • 10-24 = 4,037 •10-23 г
Относительная молекулярная масса (Mr) — безразмерная величина, показывающая, во сколько раз масса молекулы данного вещества больше 1/12 массы атома углерода 12C.
Mг = m /(1/12 m(12C))
m — масса молекулы данного вещества;
m(12C) — масса атома углерода 12C.
Относительная молекулярная масса вещества равна сумме относительных атомных масс всех элементов с учетом индексов.
Примеры.
Mг(B2O3)=2 • Ar(B) + 3 •Ar(O) = 2 •11 + 3 • 16 = 70
Mг(KAl(SO4)2) = 1 • Ar(K) + 1 • Ar(Al) + 1 • 2 • Ar(S) + 2 • 4 • Ar(O) =
= 1 • 39 + 1 • 27 + 1 • 2 • 32 + 2 • 4 •16 = 258
Абсолютная масса молекулы равна относительной молекулярной массе, умноженной на а.е.м.
Число атомов и молекул в обычных образцах веществ очень велико, поэтому при характеристике количества вещества используют специальную единицу измерения — моль.
Количество вещества. Означает определенное число структурных элементов (молекул, атомов, ионов). Обозначается n, измеряется в моль. Моль — количество вещества, содержащее столько же частиц, сколько содержится атомов в 12 г изотопа углерода-12.
Число Авогадро (NA). Количество частиц в 1 моль любого вещества одинаково и равно 6,02 • 1023. (Постоянная Авогадро имеет размерность — моль-1).
Молярная масса -это масса 1 моль вещества (обозначается M).
Молярная масса вещества численно равна его относительной молекулярной массе, однако первая величина имеет размерность г/моль, а вторая — безразмерная.
Молярная масса вещества равна отношению массы вещества к соответствующему количеству вещества.
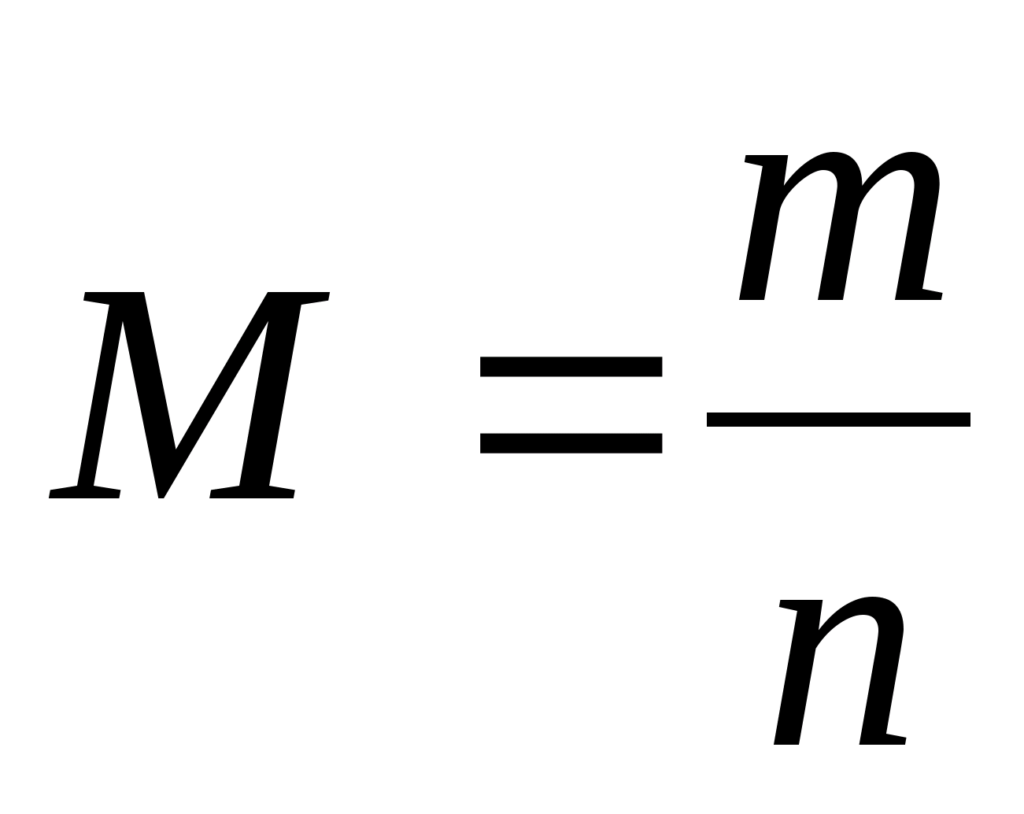
Отсюда, количества вещества равно отношению массы вещества к молярной массе
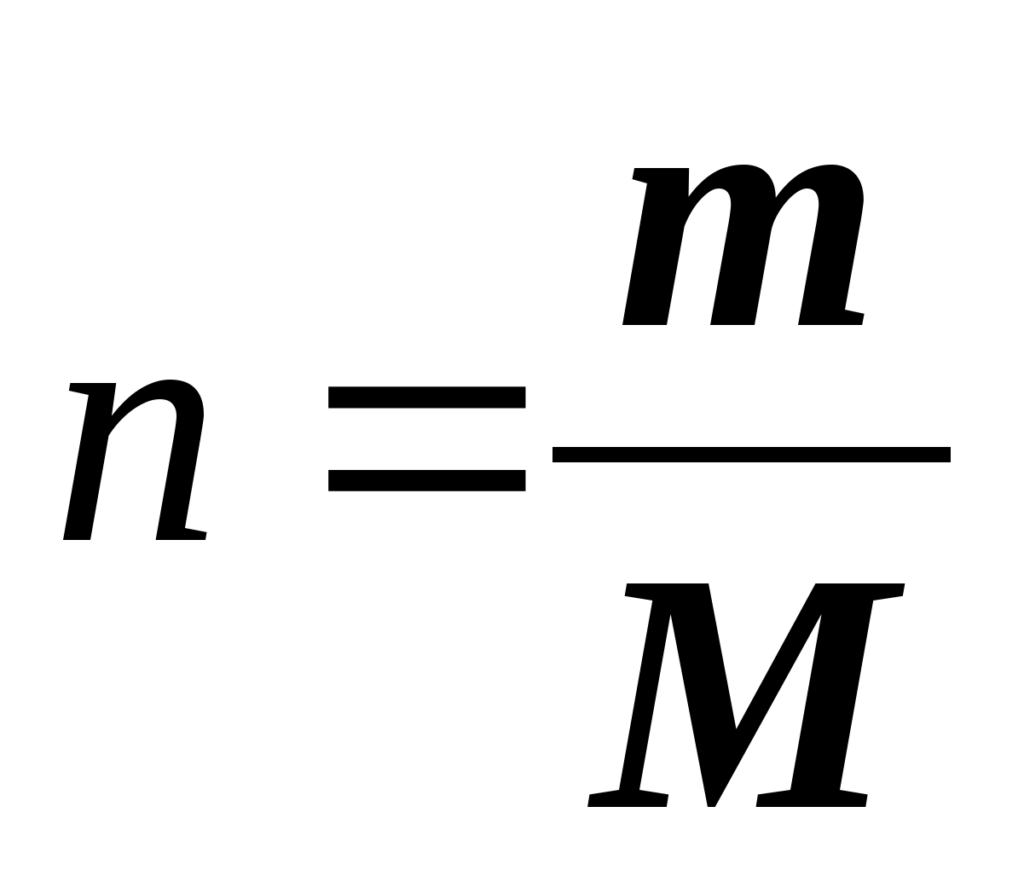
Количества вещества можно определить как отношение количества атомов или молекул к числу Авагадро:
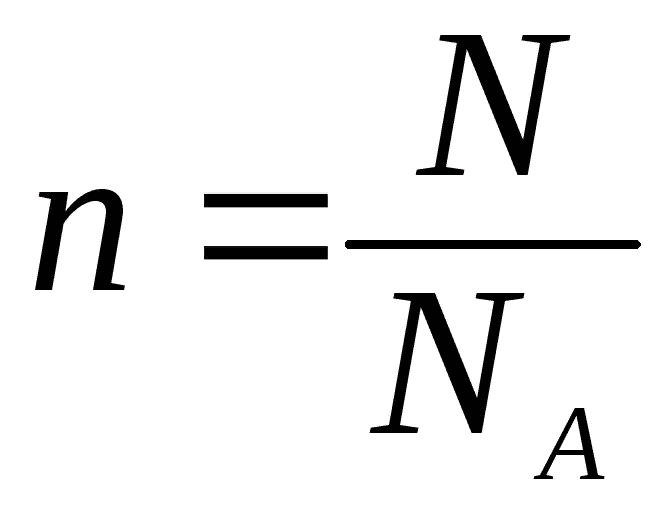
Основные законы химии
Закон сохранения массы веществ
(М.В.Ломоносов, 1748 г.; А.Лавуазье, 1789 г.)
Масса всех веществ, вступивших в химическую реакцию, равна массе всех продуктов реакции.
Атомно-молекулярное учение этот закон объясняет следующим образом: в результате химических реакций атомы не исчезают и не возникают, а происходит их перегруппировка (т.е. химическое превращение- это процесс разрыва одних связей между атомами и образование других, в результате чего из молекул исходных веществ получаются молекулы продуктов реакции). Поскольку число атомов до и после реакции остается неизменным, то их общая масса также изменяться не должна. Под массой понимали величину, характеризующую количество материи.
Исходя из закона сохранения массы веществ составляют уравнения химических реакций и производят по ним расчеты. Закон сохранения массы веществ является основой количественного химического анализа.
Составление химических уравнений
Включает три этапа:
- Записываем схему реакции:
HgO = Hg + O2
2. Подбор коэффициентов для каждого вещества так, чтобы количество атомов каждого элемента в левой и правой части уравнения было одинаково:
2HgO = 2Hg + O2
3. Проверка числа атомов каждого элемента в левой и правой частях уравнения.
Расчеты по химическим уравнениям
Стехиометрические расчеты основаны на законе сохранения массы веществ, которые производят с использованием записи уравнения и подбором коэффициентов.
В реальных химических процессах из-за неполного протекания реакций или потерь масса продуктов, реальная масса продуктов обычно меньше теоретически рассчитанной.
Выходом реакции (η) называют отношение реальной массы продукта (mp) к теоретически рассчитанной (mт), выражается в относительных единицах или в процентах.
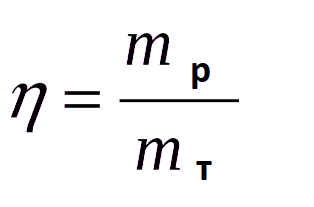
Если в условиях задач выход продуктов реакции не указан, его в расчетах принимают за 100% (количественный выход).
Задача
Сколько грамм меди образуется при восстановлении 8 г оксида меди водородом, если выход реакции составил 82%?
Закон постоянства состава вещества
Впервые сформулировал Ж.Пруст (1808 г).
Все индивидуальные химические вещества имеют постоянный качественный и количественный состав и определенное химическое строение, независимо от способа получения.
Из закона постоянства состава вещества следует, что при образовании сложного вещества элементы соединяются друг с другом в определенных массовых соотношениях.
Закон кратных отношений
(Д.Дальтон, 1803 г.)
Если два химических элемента образуют несколько соединений, то весовые доли одного элемента в этих соединениях, приходящиеся на весовые доли второго элемента, относятся между собой как небольшие целые числа.
N2O NO N2O3 NO2(N2O4) N2O5
Число атомов кислорода в молекулах этих соединений, приходящиеся на два атома азота, относятся между собой как 1 : 2 : 3 : 4 : 5.
Закон объемных отношений
(Гей-Люссак, 1808 г.)
«Объемы газов, вступающих в химическую реакцию, и объемы газов, образующихся в результате реакции, относятся между собой как небольшие целые числа».
Следствие. Стехиометрические коэффициенты в уравнениях химических реакций для молекул газообразных веществ показывают, в каких объемных отношениях реагируют или получаются газообразные вещества.
Закон Авогадро
(А. Авогадро 1811 г.)
В равных объемах различных газов при одинаковых условиях (температура, давление и т.д.) содержится одинаковое число молекул.
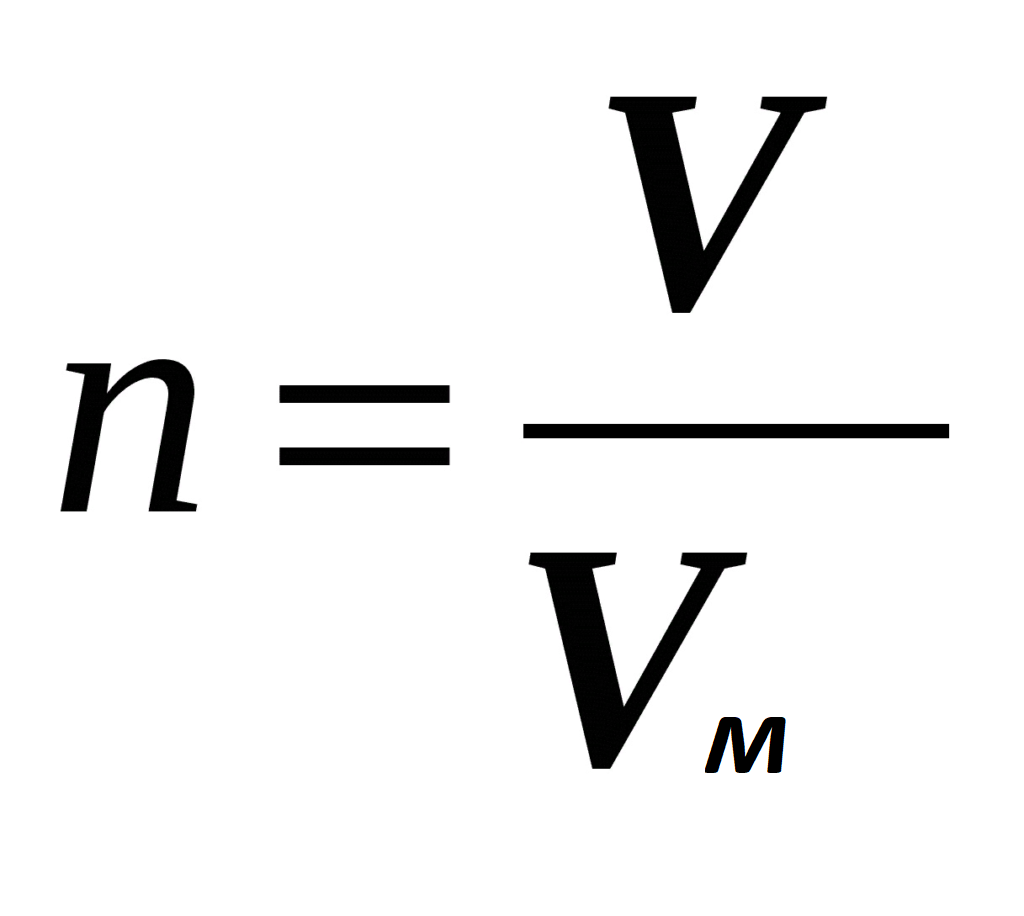
Закон справедлив только для газообразных веществ.
Следствия.
- Одно и то же число молекул различных газов при одинаковых условиях занимают одинаковые объемы.
- При нормальных условиях 1 моль любого газа занимает объем 22,4 л.( н.у: 0°C = 273°К , 1 атм = 101,3 кПа)
Vм = 22,4 л/моль
Задача
Какой объем водорода при н.у. выделится при взаимодействии 4,8 г магния с избытком соляной кислоты?
Объединенный газовый закон
Объединенный газовый закон — объединение трех независимых частных газовых законов: Гей-Люссака, Шарля, Бойля-Мариотта, уравнение, которое можно записать так:
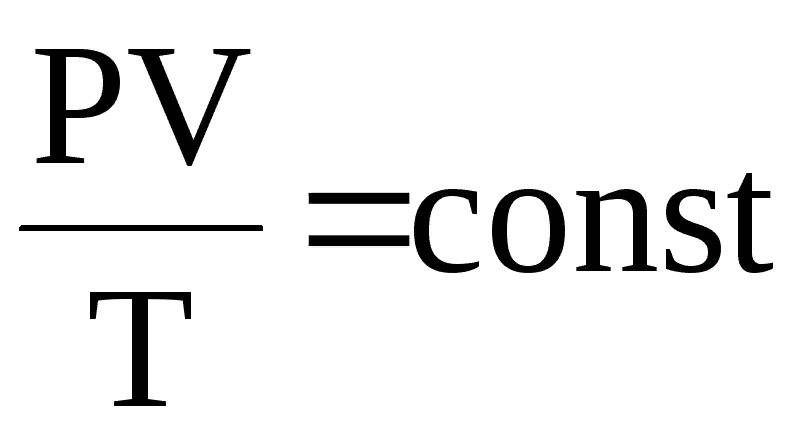
или в другой форме
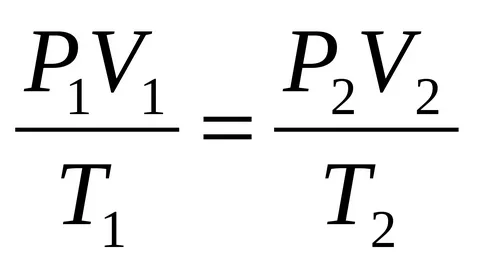
И наоборот, из объединенного газового закона
при P = const (P1 = P2) можно получить
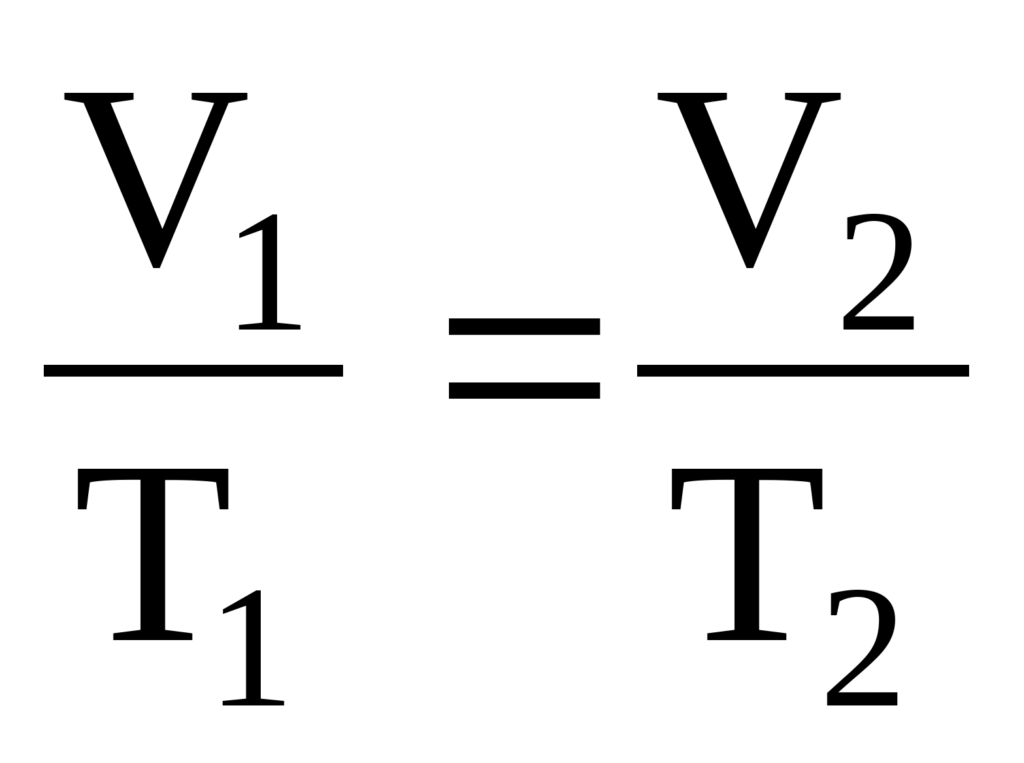
(закон Гей-Люссака);
при Т= const (T1 = T2):
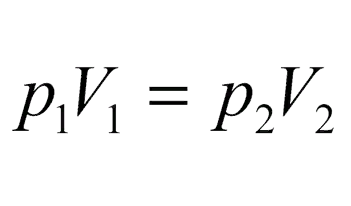
(закон Бойля-Мариотта);
при V = const
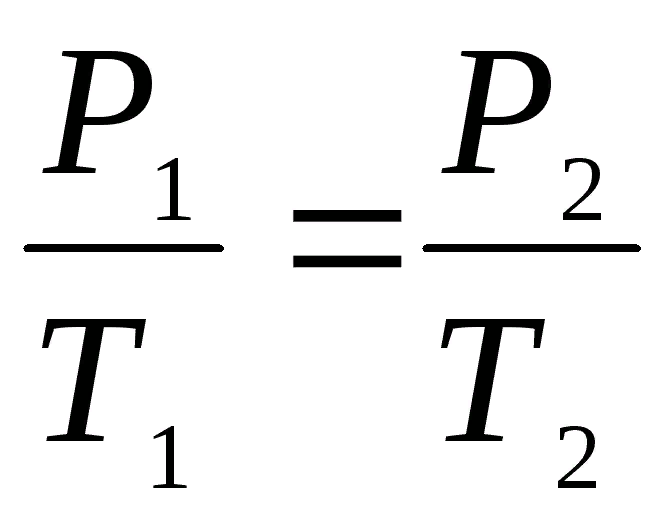
(закон Шарля).
Уравнение Клапейрона-Менделеева
Если записать объединенный газовый закон для любой массы любого газа, то получается уравнение Клапейрона-Менделеева:
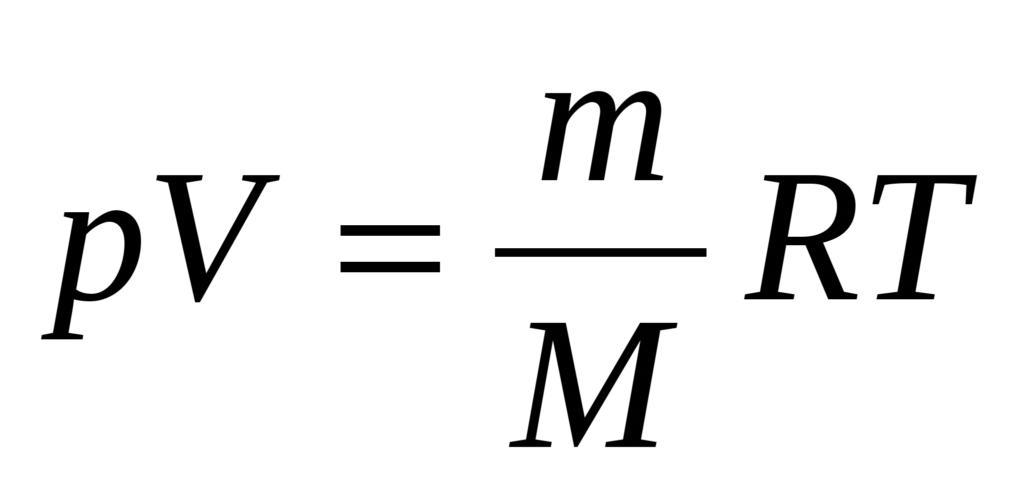
где m — масса газа; M — молекулярная масса; p — давление; V — объем; T — абсолютная температура (°К); R — универсальная газовая постоянная (8,314 Дж/(моль • К) или 0,082 л атм/(моль • К)).
Для данной массы конкретного газа отношение m / M постоянно, поэтому из уравнения Клапейрона-Менделеева получается объединенный газовый закон.
Пример.
Какой объем займет при температуре 17°C и давлении 250 кПа оксид углерода (II) массой 84 г?
Относительная плотность газов
Относительная плотность газов D показывает, во сколько раз 1 моль одного газа тяжелее (или легче) 1 моля другого газа.
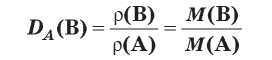
Задачи:
Химические явления. Вещества
- Среди перечисленных явлений выберите те, которые являются химическими: а) испарение воды; б) горение древесины; в) потемнение серебряных изделий; г) выделение попутного газа при бурении нефтяных скважин; д) ржавление железа.
- При добавлении серной кислоты к воде происходит сильный разогрев смеси. Какое явление при этом происходит: физическое или химическое? Ответ поясните.
- Какие из перечисленных признаков характеризуют химические явления: а) изменение цвета; б) изменение агрегатного состояния; в) изменение формы; г) образование осадка?
- Происходят ли химические явления при следующих процессах: а) таянии льда; б) перегонке воды; в) ржавлении железа; г) разделении смеси фильтрованием; д) гниении продуктов?
- Какие из перечисленных веществ относятся к простым, а какие к сложным: а) углекислый газ; б) соль; в) медь; г) водород; д) алюминий; е) мрамор? В чем состоит различие между этими группами веществ?
- При сгорании неизвестного сложного вещества в кислороде образуются углекислый газ и вода. Какие химические элементы могут присутствовать в этом сложном веществе? Какие из них присутствуют обязательно? Ответ поясните.
Относительные атомные и молекулярные массы. Постоянство состава вещества
- Средняя масса атомов серы равна 5,31 • 10-23 г. Вычислите относительную атомную массу элемента серы, если масса атома углерода равна 1,993 • 10-23 г.
- Рассчитайте, во сколько раз масса атома кислорода больше массы атома гелия.
- Относительная атомная масса фтора равна 19. Определите среднюю массу атома фтора (в г), учитывая, что масса атома углерода равна 1,993 • 10-23 г.
- Рассчитайте относительную молекулярную массу следующих сложных веществ: а) хлорида магния MgCl2;
б) серной кислоты H2SO4, в) гидроксида кальция г) оксида алюминия Аl2О3, д) борной кислоты НзВОз; е) сульфата меди (II) CuS04.
- Магний реагирует с серой. Определите массу магния, который прореагирует с 20 г серы.
- Алюминий и углерод реагируют при нагревании, образуя карбид алюминия. Сколько надо взять углерода для реакции с 15 г алюминия? Сколько карбида алюминия будет получено при этом?