Окислительно- восстановитедьными называются реакции, протекающие с изменением степени окисления химических элементов.
Степень окисления
Степень окисления — это условный заряд атома в молекуле, вычисленный на основании того, что молекула состоит из ионов и в целом электронейтральна.
Наиболее электроотрицательные элементы в соединении имеют отрицательные степени окисления, а атомы элементов с меньшей электроотрицательностью — положительные.
Степень окисления — формальное понятие; как правило степень окисления совпадает с валентностью.
Валентность — это количество связей, которые образует атом в молекуле.
Расчет степени окисления
Основные положения:
- Степени окисления атомов в простых веществах равны нулю (Na0; H20).
- Алгебраическая сумма степеней окисления всех атомов, входящих в состав молекулы, всегда равна нулю, а в сложном ионе эта сумма равна заряду иона.
- Постоянную степень окисления имеют атомы: щелочных металлов (+1), щелочноземельных металлов (+2), водорода (+1) (кроме гидридов NaH, CaH2 и др., где степень окисления водорода -1), кислорода (-2) (кроме F2-1O+2 и пероксидов, содержащих группу –O–O–, в которой степень окисления кислорода -1), галогены в бинарных соединениях с металлами -1.
- Для элементов положительная степень окисления не может превышать величину, равную номеру группы периодической системы.
Примеры:
V2+5O5-2; N-3H3+1; K+1Cl+7O4-2; K2+1H+1P+5O4-2; Na2+1Cr2+6O7-2 ; Na2+1B4+3O7-2;
Реакции без и с изменением степени окисления
Существует два типа химических реакций:
A Реакции, в которых не изменяется степень окисления элементов:
Реакции присоединения
SO2 + Na2O = Na2SO3
2H2 + O2 = 2H2O
Реакции разложения
Cu(OH)2 = CuO + H2O
2HgO = 2Hg + O2
Реакции обмена
AgNO3 + KCl = AgCl¯ + KNO3
NaOH + HNO3 = NaNO3 + H2O
B Реакции, в которых происходит изменение степеней окисления атомов элементов, входящих в состав реагирующих соединений:
2Mg0 + O20 = 2Mg+2O-2
2KCl+5O3-2 = 2KCl-1 + 3O20
2KI-1 + Cl20 = 2KCl-1 + I20
Mn+4O2 + 4HCl-1 = Mn+2Cl2 + Cl20 + 2H2O
Такие реакции называются окислительно — восстановительными.
Окисление, восстановление
В окислительно-восстановительных реакциях электроны от одних атомов переходят к другим.
Окисление — это процесс отдачи электронов. При окислении степень окисления повышается:
H20 — 2ē = 2H+
S-2 — 2ē = S0
Al0 — 3ē = Al+3
Fe+2 — ē = Fe+3
2Br — — 2ē = Br20
Атом, отдающий электроны ē, называется восстановителем.
Восстановление — это процесс присоединения электронов. При восстановлении степень окисления понижается.
Mn+4 + 2ē = Mn+2
S0 + 2ē = S-2
Cr+6 +3ē = Cr+3
Cl20 +2ē = 2Cl—
O20 + 4ē = 2O-2
Атомы, присоединяющие электроны ē, являются окислителями.
Окислительно-восстановительные свойства вещества и степени окисления входящих в него атомов
Соединения, содержащие атомы элементов с максимальной степенью окисления, могут быть только окислителями за счет этих атомов, т.к. они уже отдали все свои валентные электроны и способны только принимать электроны. Максимальная степень окисления атома элемента равна номеру группы в периодической таблице, к которой относится данный элемент. Соединения, содержащие атомы элементов с минимальной степенью окисления могут служить только восстановителями, поскольку они способны лишь отдавать электроны, потому, что внешний энергетический уровень у таких атомов завершен восемью электронами. Минимальная степень окисления у атомов металлов равна 0, для неметаллов — (n–8) (где n- номер группы в периодической системе). Соединения, содержащие атомы элементов с промежуточной степенью окисления, могут быть и окислителями и восстановителями, в зависимости от партнера, с которым взаимодействуют и от условий реакции.
Важнейшие восстановители и окислители
| Восстановители | Окислители |
| Металлы, водород, уголь. Окись углерода (II) (CO). Сероводород (H2S); оксид серы (IV) (SO2); сернистая кислота H2SO3 и ее соли. Галогеноводородные кислоты и их соли. Катионы металлов в низших степенях окисления: SnCl2, FeCl2, MnSO4, Cr2(SO4)3. Азотистая кислота HNO2; аммиак NH3; гидразин NH2NH2; оксид азота(II) (NO). Катод при электролизе. | Галогены. Перманганат калия(KMnO4); манганат калия (K2MnO4); оксид марганца (IV) (MnO2). Дихромат калия (K2Cr2O7); хромат калия (K2CrO4). Азотная кислота (HNO3). Серная кислота (H2SO4) конц. Оксид меди(II) (CuO); оксид свинца(IV) (PbO2); оксид серебра (Ag2O); пероксид водорода (H2O2). Хлорид железа(III) (FeCl3). Бертоллетова соль (KClO3). Анод при электролизе. |
Классификация окислительно-восстановительных реакций
Межмолекулярные окислительно-восстановительные реакции
Окислитель и восстановитель находятся в разных веществах; обмен электронами в этих реакциях происходит между различными атомами или молекулами:
S0 + O20 = S+4O2-2
S — восстановитель; O2 — окислитель
Cu+2O + C+2O = Cu0 + C+4O2
CO — восстановитель; CuO — окислитель
Zn0 + 2HCl = Zn+2Cl2 + H20
Zn — восстановитель; HСl — окислитель
Mn+4O2 + 2KI-1 + 2H2SO4 = I20 + K2SO4 + Mn+2SO4 + 2H2O
KI — восстановитель; MnO2 — окислитель.
Сюда же относятся реакции между веществами, в которых атомы одного и того же элемента имеют разные степени окисления
2H2S-2 + H2S+4O3 = 3S0 + 3H2O
Внутримолекулярные окислительно- восстановительные реакции
Во внутримолекулярных реакциях окислитель и восстановитель находятся в одной и той же молекуле. Внутримолекулярные реакции протекают, как правило, при термическом разложении веществ, содержащих окислитель и восстановитель.
2KCl+5O3-2 = 2KCl-1 + 3O20
Cl+5 — окислитель; О-2 — восстановитель
N-3H4N+5O3 = N2+1O + 2H2O
N+5 — окислитель; N-3 — восстановитель
2Pb(N+5O3-2)2 = 2PbO + 4N+4O2 + O20
N+5 — окислитель; O-2 — восстановитель
Опыт. Разложение дихромата аммония
(N-3H4)2Cr2+6O7 = Cr2+3O3 + N20 + 4H2O
Cr+6 — окислитель; N-3 — восстановитель.
Диспропорционирование — окислительно-восстановительная реакция, в которой один элемент одновременно повышает и понижает степень окисления.
Cl20 + 2KOH = KCl+1O + KCl-1 + H2O
3K2Mn+6O4 + 2H2O = 2KMn+7O4 + Mn+4O2 + 4KOH
3HN+3O2 = HN+5O3 + 2N+2O + H2O
2N+4O2 + 2KOH = KN+5O3 + KN+3O2 + H2O
Составление уравнений окислительно-восстановительных реакций
Подбор коэффициентов методом электронного баланса.
Электронный баланс — метод нахождения коэффициентов в уравнениях окислительно-восстановительных реакций, в котором происходит обмен электронами между атомами элементов, изменяющих свою степень окисления.
Число электронов, отданное восстановителем равно числу электронов, получаемых окислителем.
Уравнение составляется в несколько стадий:
- Записывают схему реакции.
KMnO4 + HCl = KCl + MnCl2 + Cl2 + H2O
2. Определяют степени окисления элементов, которые её меняют.
KMn+7O4 + HCl-1 = KCl + Mn+2Cl2 + Cl20 + H2O
3. Выделяют элементы, изменяющие степени окисления и определяют число электронов, принятых окислителем и отданных восстановителем.
восстановление Mn+7 + 5ē = Mn+2 окислитель
окисление 2Cl-1 — 2ē = Cl20 восстановитель
4. Уравнивают число принятых и отданных электронов с помощью множителей, устанавливая тем самым коэффициенты для соединений, изменяющих степень окисления.
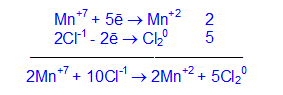
5. Подбирают коэффициенты для остальных участников реакции.
2KMnO4 + 16HCl = 2KCl + 2MnCl2 + 5Cl2 + 8H2O
6. Проверяем количество атомов в левой и правой части уравнения, оно должно быть одинаковы.
Задания:
1) Методом электронного баланса подберите коэффициенты в схемах реакций, лежащих в основе
получения металлов:
a) Mn2O3 + Si → SiO2 + Mn
б) FeO + Al → Al2O3 + Fe
2) Подберите коэффициенты в схемах следующих окислительно-восстановительных реакций методом электронного баланса:
a) Na2S + KMnO4 + H2O → S + MnO2 + NaOH + KOH
б) FeSO4 + KMnO4 + H2SO4 → Fe2(SO4)3 + MnSO4 + K2SO4 + H2O
в) KBr + KMnO4 + H2SO4 → Br2 + MnSO4 + K2SO4 + H2O
г) K2S + KMnO4 + H2SO4 → S + MnSO4 + K2SO4 + H2O