Открыт Ж. Гей-Люссаком и Л.Тенаром в 1811г.
Второй по распространённости элемент в земной коре (27,6% по массе)
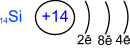
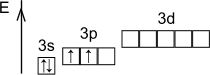
Возбуждённое состояние
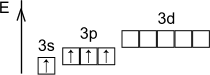
Степени окисления: +4, -4.
Аллотропия
Кристаллический – тёмно-серое вещество с металлическим блеском, большая твёрдость, хрупок, полупроводник; r = 2,33 г/см3, t°пл. =1415°C; t°кип. = 2680°C.

Имеет алмазоподобную структуру (sp3— гибридизация атомов кремния) и образует прочные ковалентные s- связи. Инертен.
Аморфный — бурый порошок, гигроскопичен, алмазоподобная структура, r = 2 г/см3, более реакционноспособен.

Получение
1 способ
2С + Si+4O2 –t°-> Si0 + 2CO
2 способ
2Mg + Si+4O2 –t°-> 2MgO + Si0
Химические свойства
Типичный неметалл, инертен.
Как восстановитель:
- С кислородом
Si0 + O2 –t°-> Si+4O2
2. С фтором (без нагревания)
Si0 + 2F2 -> SiF4
3. С углеродом
Si0 + C –t°-> Si+4C
(SiC — карборунд -твёрдый; используется для точки и шлифовки)
4. С водородом не взаимодействует. Силан (SiH4) получают разложением силицидов металлов кислотой:
Mg2Si + 2H2SO4 -> SiH4 + 2MgSO4
5. С кислотами не реагирует. Растворяется только в смеси азотной и плавиковой кислот:
3Si + 4HNO3 + 18HF -> 3H2[SiF6] + 4NO + 8H2O
6. Со щелочами (при нагревании):
Si0 + 2NaOH + H2O -> Na2Si+4O3+ 2H2
Как окислитель:
7. С металлами (образуются силициды):
Si0 + 2Mg –t°-> Mg2Si-4
Соединения кремния
Силан SiH4
Бесцветный газ, ядовит, t°пл. = -185°C, t°кип. = -112°C.
Получение
Mg2Si + 4HCl -> 2MgCl2 + SiH4
Химические свойства
SiH4 + 2O2 -> SiO2 + 2H2O
2.
SiH4 -> Si + 2H2
Оксид кремния (IV) (SiO2)n
SiO2 — кварц, горный хрусталь, аметист, агат, яшма, опал, кремнозём (основная часть песка)
Al2O3 •2SiO2 • 2H2O — каолинит (основная часть глины)
K2O • Al2O3 • 6SiO2 — ортоклаз (полевой шпат)
Физические свойства
Твёрдое, тугоплавкое вещество, t°пл.= 1728°C, t°кип.= 2590°C
Кислотный оксид
При сплавлении взаимодействует с основными оксидами, щелочами, а также с карбонатами щелочных и щелочноземельных металлов:
- С основными оксидами:
SiO2 + CaO -> CaSiO3
2. Со щелочами:
SiO2 + 2NaOH -> Na2SiO3 + H2O
3. С водой не реагирует
4. С солями:
SiO2 + CaCO3 -> CaSiO3 + CO2
SiO2 + K2CO3 -> K2SiO3 + CO2
5. С плавиковой кислотой:
SiO2 + 4HF -> SiF4 + 2H2O
SiO2 + 6HF -> H2[SiF6](гексафторкремниевая кислота) + 2H2O
(реакции лежат в основе процесса травления стекла).
Кремниевые кислоты
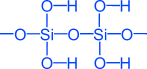
x • SiO2 • y H2O
x = 1, y = 1 H2SiO3 — метакремниевая кислота
x = 1, y = 2 H4SiO4 — ортокремниевая кислота и т.д.
H2SiO3 — очень слабая (слабее угольной), непрочная, в воде малорастворима (образует коллоидный раствор), не имеет кислого вкуса.
Получение
Na2SiO3 + 2HCl -> 2NaCl + H2SiO3¯
При нагревании разлагается:
H2SiO3 –t°-> H2O + SiO2
Соли кремниевой кислоты — силикаты.
Выветривание горных пород (разрушение минералов):
(K2O • Al2O3 • 6SiO2)(полевой шпат) + CO2 + 2H2O -> (Al2O3 • 2SiO2 • 2H2O)(каолинит (глина)) + 4SiO2(кремнезём (песок)) + K2CO3
Применение
Кремний – основной материал микроэлектроники и полупроводниковых приборов; используется при изготовлении стёкол, прозрачных для ИК-излучения. Кремний является компонентом сплавов железа и цветных металлов (в малых концентрациях кремний повышает коррозионную стойкость и механическую прочность сплавов, улучшает их литейные свойства; в больших концентрациях может вызвать хрупкость); наибольшее значение имеют железные, медные и алюминиевые кремнийсодержащие сплавы. Кремний применяют в качестве исходного вещества для получения кремнийорганических соединений и силицидов.
Биологическая роль
Кремний относится к микроэлементам. Суточная потребность человека в кремнии 20–50 мг (элемент необходим для правильного роста костей и соединительных тканей). В организм человека кремний попадает с пищей, а также с вдыхаемым воздухом в виде пылеобразного SiO2. При длительном вдыхании пыли, содержащей свободный SiO2, возникает силикоз.
Задачи:
- Для получения кремния из оксида кремния(IV) В качестве восстановителя использовали кокс: SiO2 + 2C = Si + 2CO Рассчитайте массу оксида кремния (IV), который можно восстановить с помощью кокса массой 50 кг (массовая доля углерода в коксе составляет 95%).
- Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Si → SiO2 → Na2SiO3 → H2SiO3 - С помощью каких реакций можно осуществить следующие превращения:
H2SiO3 → SiO2 → Si → K2SiO3
Напишите уравнения этих реакций. - Состав минерала асбеста можно выразить формулой 3MgSiO3 • CaSiO3 Определите массовую долю оксида кремния (IV) в асбесте.
- Смесь кремния и угля массой 5 г обработали концентрированным раствором щелочи при нагревании (щелочь в избытке). В результате реакции выделился водород объемом 2,8 л (нормальные условия). Вычислите массовую долю углерода в этой смеси
- Смесь карбоната натрия и карбоната калия массой 20 кг сплавили с оксидом кремния (IV) из реакционной смеси выделили силикат натрия массой 12,2 кг. Вычислите массовую долю Na2CO3 в исходной смеси карбонатов.