
Коррозия – это процесс разрушения металлов и сплавов вследствие взаимодействия с окружающей средой.
Коррозия металлов наносит большой экономический ущерб. В результате взаимодействия металлов с окружающей средой выходит из строя оборудование, машины, механизмы, разрушаются металлические конструкции. В большей степени подвергается коррозии аппаратура химической промышленности в результате контакта с агрессивными веществами.
Коррозионное разрушение может носить как сплошной, так и локальный характер.
Коррозия подразделяется на химическую и электрохимическую.
Химическая коррозия
Х. к. происходит при контакте металлов с растворами неэлектролитов или газами при высокой температуре. В данном случае наиболее опасными окислителями являются: O2, пары воды, CO2, SO2
Коррозионное разрушение при взаимодействии с O2 происходит по следующей схеме:
4Fe0 + 3O2 -> 2Fe2O3
При повышении температуры скорость газовой коррозии возрастает.
Электрохимическая коррозия
Э.к. происходит при контакте металлов с растворами электролитов. На практике э.к. протекает при погружении металлических изделий в водные растворы, морскую воду, в почву, при конденсации влаги из атмосферы. При э.к. на металлах протекают одновременно два процесса:
- окисление металла
М – nē -> Мn+ - восстановление окислителей
Ок + nē -> В.ф.
В результате окисления металла происходит его растворение.
Как правило в водных р-рах в качестве ок. выступают ионы водорода или растворённый в воде кислород.
Рассмотрим в качестве примера э.к. железа:
- с водородом
2H+ + 2ē -> H2 - с кислородом
O2 + 2H2O+ 4ē -> 4OH—
- в кислой среде
Fe0 — 2ē -> Fe2+
2H+ + 2ē -> H20.
––––––––––––––––––––––––
Fe0+ 2H+ -> Fe2+ + H20 - в нейтральной и щелочной среде
Fe0 — 2ē -> Fe2+
O2 + 2H2O+ 4ē -> 4OH—
––––––––––––––––––––––––
2Fe0+ O2 + 2H2O -> 2Fe(OH)2
Образующийся гидроксид железа(II) легко окисляется воздухом
4Fe(OH)2+ O2 + 2H2O -> 4Fe(OH)3
Продукт коррозии бурая ржавчина представляет сложную смесь двух вышеперечисленных гидроксидов.
Металлы с положительным электродным потенциалом подвергаются коррозии только с участием кислорода во всех средах.
Cu0 — 2ē -> Cu2+
O2 + 2H2O + 4ē -> 4OH—
––––––––––––––––––––––––
2Cu0+ O2 + 2H2O -> 2Cu(OH)2
Защита металлов от коррозии
Для предупреждения коррозии используют комплекс мер: нанесение металлических и неметаллических покрытий, легирование, химические и элетрохимические методы.
- Нанесение металлических покрытий
В целях защиты используют покрытия слоем металлов: Zn, Ni, Cr, Pb, Sn, Cu, Cd и др.
Данные покрытия обладают достаточно высокой прочностью и обеспечивают электрохимическую защиту.

2. Нанесение неметаллических покрытий
Эффективную защиту обеспечивают различные лакокрасочные покрытия. Используют: лаки, краски, полимеры. Эти покрытия отличаются хорошей водостойкостью и обеспечивают мех. защиту мет. от к.

3. Легирование металлов
Увеличивают к. защиту использованием сплавов с различными легирующими добавками: Ni, Cr, Мо(для Fe), Be, Al (для Cu), Ni, Cr (для Al)

4. Электрохимические методы защиты
а) протекторная защита
К металлам подвергающимся коррозии присоединяют протекторы – более активные металлы( т.е. металлы с более отрицательным электродным потенциалом) При этом два металла образуют гальваническую пару, где основной металл защищается электронами выделяющимися при окислении металла — протектора.

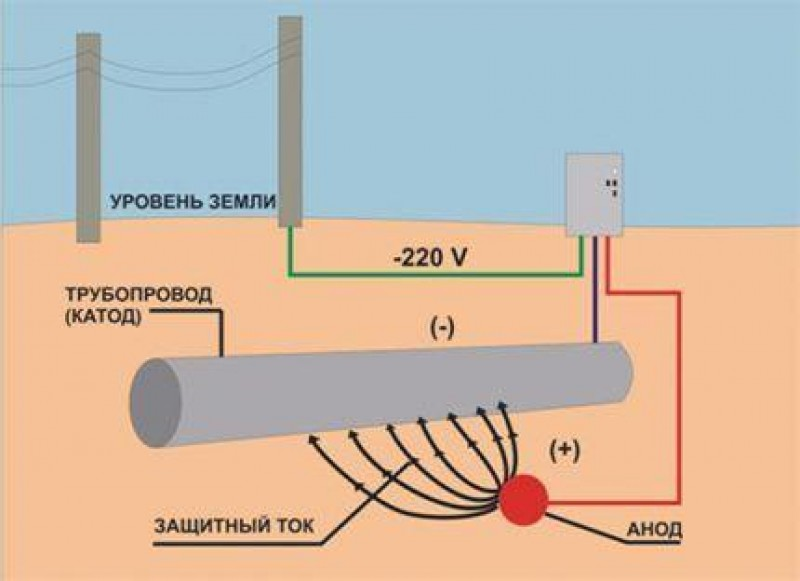
б) катодная защита
Защищаемую поверхность соединяют с отрицательным полюсом источника постоянного тока, т.е. она служит катодом. Положительный полюс присоединят к другому вспомогательному металлу, который помещают в ту же среду. Поверхность металла будет защищена электронами от источника постоянного тока.
Применяется от морской и почвенной коррозии.
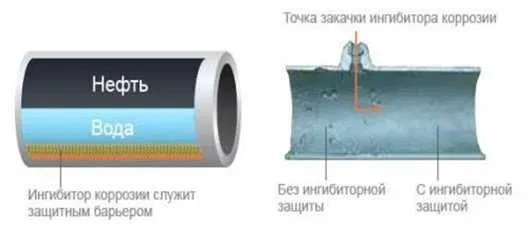
5. Химические методы защиты
Для данного способа защиты используют ингибиторы коррозии – вещества, снижающие скорость коррозии. В качестве ингибиторов используют широкий спектр неорг., орг. веществ и смесей.
Задачи:
- Если пластинку из чистого цинка опустить в разбавленную кислоту, то начавшееся выделение водорода вскоре почти прекращается. Однако при прикосновении к цинку медной палочкой на последней начинается бурное выделение водорода. Дайте этому объяснение, составив электронные уравнения анодного и катодного процессов. Напишите уравнения протекающей химической реакции.
- В чем сущность протекторной защиты металлов от коррозии? Приведите пример протекторной защиты железа в электролите, содержащем растворенный кислород. Составьте электронные уравнения анодного и катодного процессов.
- Железное изделие покрыли никелем. Какое это покрытие — анодное или катодное? Почему? Составьте электронные уравнения анодного и катодного процессов коррозии этого изделия при нарушении покрытия во влажном воздухе и в хлороводородной (соляной) кислоте. Какие продукты коррозии образуются в первом и во втором случаях?
- Какой металл целесообразней выбрать для протекторной защиты от коррозии свинцовой оболочки кабеля: цинк, магний или хром? Почему? Составьте электронные уравнения анодного и катодного процессов атмосферной коррозии. Каков состав продуктов коррозии?
- Цинковую и железную пластинки опустили в раствор сульфата меди. Составьте электронные и ионно-молекулярные уравнения реакций, происходящих на каждой из этих пластинок. Какие процессы будут проходить на пластинках, если наружные концы их соединить проводником?