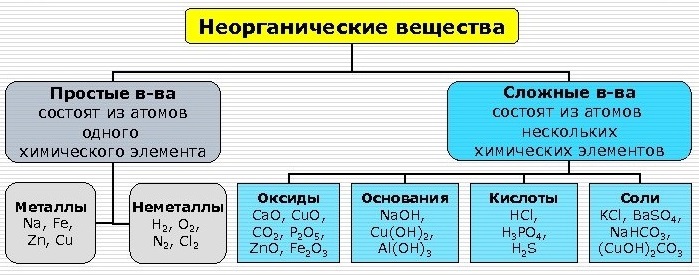
Простые вещества. Молекулы состоят из атомов одного вида (атомов одного элемента). В химических реакциях не могут разлагаться с образованием других веществ.
Сложные вещества (или химические соединения). Молекулы состоят из атомов разного вида (атомов различных химических элементов). В химических реакциях разлагаются с образованием нескольких других веществ.
Металлы обладают выраженными восстановительными свойствами, а неметаллы — окислительными. Резкой границы между металлами и неметаллами нет, т.к. есть простые вещества, проявляющие двойственные свойства.
ОСНОВНЫЕ КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
ОКСИДЫ
Оксиды — это сложные вещества, состоящие из двух элементов, один из которых кислород.
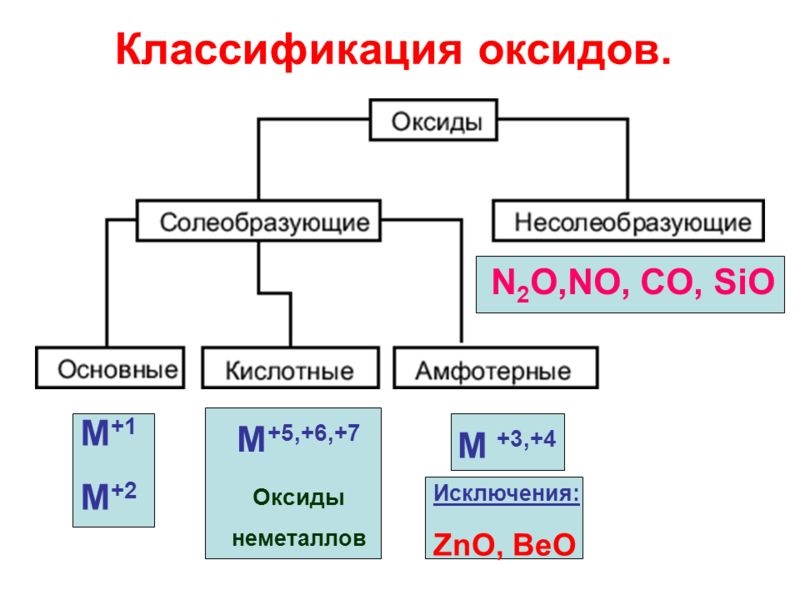
| ОКСИДЫ | |
| Несолеобразующие | CO, N2O, NO |
| Солеобразующие | Основные -это оксиды металлов, в которых последние проявляют наибольшую степень окисления +1, +2 Na2O; MgO; CuO |
| Амфотерные (обычно для металлов со степенью окисления +3, +4). В качестве гидратов им соответствуют амфотерные гидроксиды ZnO; Al2O3; Cr2O3; SnO2 | |
| Кислотные -это оксиды неметаллов и металлов со степенью окисления от +5 до +7 SO2; SO3; P2O5; Mn2O7; CrO3 | |
Основным оксидам соответствуют основания, кислотным – кислоты, амфотерным – и те и другие |
Получение
- Взаимодействие простых и сложных веществ с кислородом:
2Mg + O2 = 2MgO
4P + 5O2 = 2P2O5
S + O2 = SO2
2CO + O2 = 2CO2
2CuS + 3O2 = 2CuO + 2SO2
CH4 + 2O2 = CO2 + 2H2O
4NH3 + 5O2 = 4NO + 6H2O
2. Разложение некоторых кислородсодержащих веществ (оснований, кислот, солей) при нагревании:
Cu(OH)2 = CuO + H2O
(CuOH)2CO3 = 2CuO + CO2 + H2O
2Pb(NO3)2 = 2PbO + 4NO2 + O2
2HMnO4 = Mn2O7 + H2O
Химические свойства
| Основные оксиды | Кислотные оксиды |
| Взаимодействие с водой | |
| Образуется основание: Na2O + H2O = 2NaOH CaO + H2O = Ca(OH)2 | Образуется кислота: SO3 + H2O = H2SO4 P2O5 + 3H2O = 2H3PO4 |
| Взаимодействие с кислотой или основанием: | |
| При реакции с кислотой образуется соль и вода MgO + H2SO4 = MgSO4 + H2O CuO + 2HCl = CuCl2 + H2O | При реакции с основанием образуется соль и вода CO2 + Ba(OH)2 = BaCO3 + H2O SO2 + 2NaOH = Na2SO3 + H2O |
| Амфотерные оксиды взаимодействуют | |
| с кислотами как основные: ZnO + H2SO4 = ZnSO4 + H2O | с основаниями как кислотные: ZnO + 2NaOH = Na2ZnO2 + H2O (ZnO + 2NaOH + H2O = Na2[Zn(OH)4]) |
| Взаимодействие основных и кислотных оксидов между собой приводит к солям. | |
| Na2O + CO2 = Na2CO3 | |
| Восстановление до простых веществ: | |
| 3CuO + 2NH3 = 3Cu + N2 + 3H2O P2O5 + 5C = 2P + 5CO |
ОСНОВАНИЯ
Основания — сложные вещества, в которых атомы металлов соединены с одной или несколькими гидроксильными группами (с точки зрения теории электролитической диссоциации, основания — сложные вещества, при диссоциации которых в водном растворе образуются катионы металла (или NH4+) и гидроксид — анионы OH—).
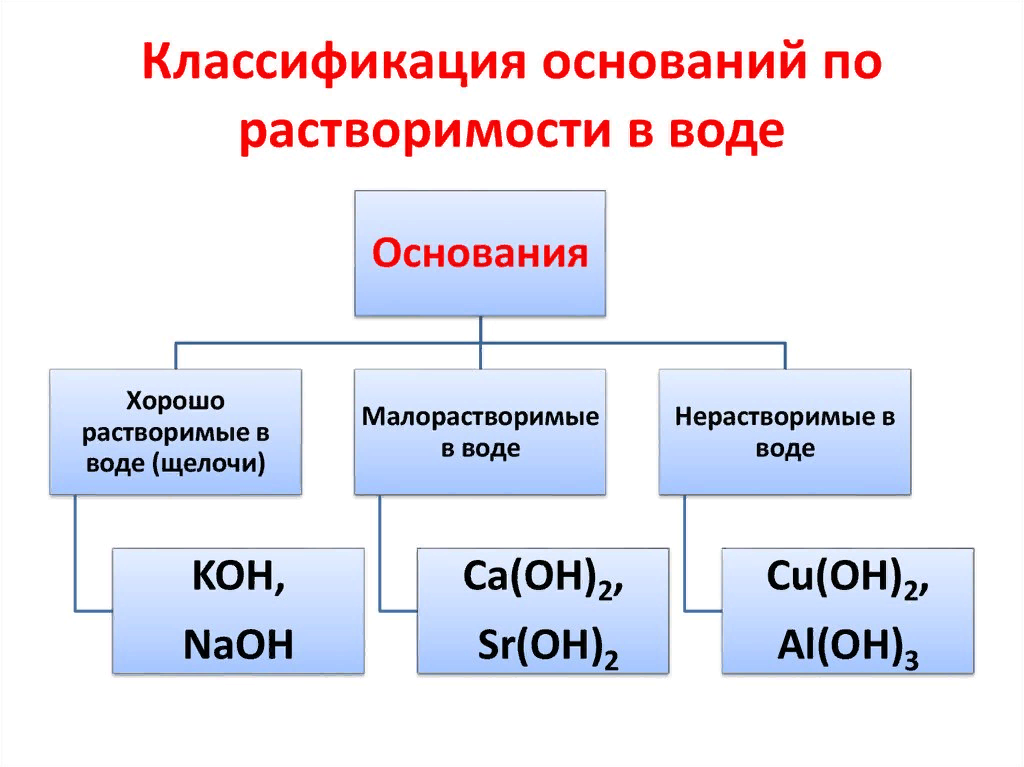
Классификация. Растворимые в воде (щёлочи) и нерастворимые. Амфотерные основания проявляют также свойства слабых кислот.
Получение
- Реакции активных металлов ( щелочных и щелочноземельных металлов) с водой:
2Na + 2H2O = 2NaOH + H2
Ca + 2H2O = Ca(OH)2 + H2
2. Взаимодействие оксидов активных металлов с водой:
BaO + H2O = Ba(OH)
3. Электролиз водных растворов солей
2NaCl + 2H2O = 2NaOH + H2 + Cl2
Химические свойства
| Щёлочи | Нерастворимые основания |
| Действие на индикаторы. | |
| лакмус — синий метилоранж — жёлтый фенолфталеин – малиновый | –– |
| Взаимодействие с кислотными оксидами. | |
| 2KOH + CO2 = K2CO3 + H2O KOH + CO2 = KHCO3 | –– |
| Взаимодействие с кислотами (реакция нейтрализации) | |
| NaOH + HNO3 = NaNO3 + H2O | Cu(OH)2 + 2HCl = CuCl2 + 2H2O |
| Обменная реакция с солями | |
| Ba(OH)2 + K2SO4 = 2KOH + BaSO4 3KOH+Fe(NO3)3 = Fe(OH)3 + 3KNO3 | –– |
| Термический распад. | |
| –– | Cu(OH)2 = CuO + H2O |
КИСЛОТЫ
Кислоты — сложные вещества, состоящие из атомов водорода и кислотного остатка. (С точки зрения теории электролитической диссоциации: кислоты — электролиты, которые при диссоциации в качестве катионов образуют только H+).
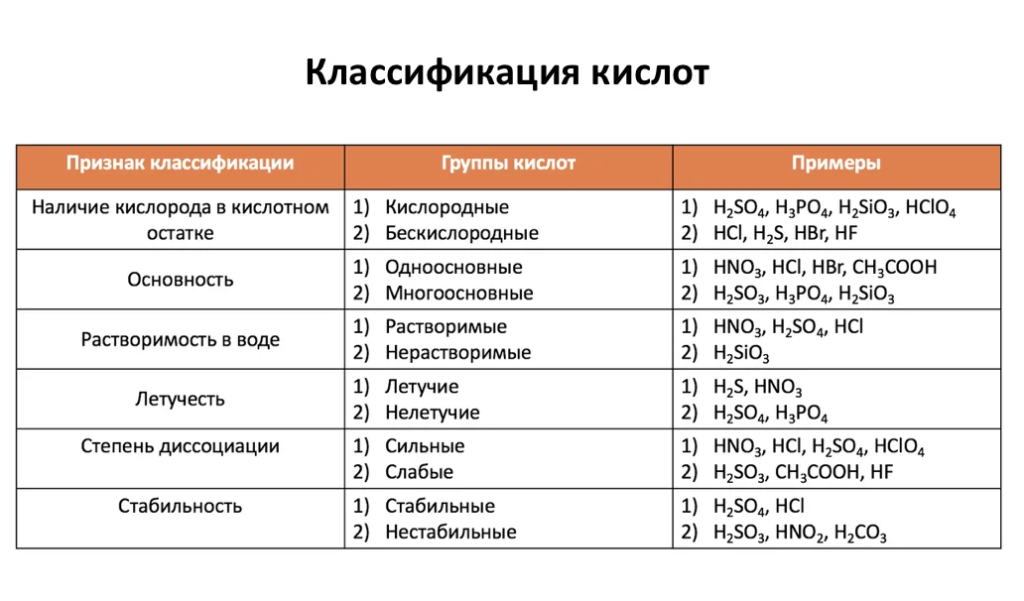
Наименование кислот и кислотных остатков
| Бескислородные: | Название соли | |
| HCl — хлористоводородная (соляная) | одноосновная | хлорид |
| HBr – бромистоводородная | одноосновная | бромид |
| HI – йодистоводородная | одноосновная | йодид |
| HF — фтористоводородная (плавиковая) | одноосновная | фторид |
| H2S – сероводородная | двухосновная | сульфид |
| Кислородсодержащие: | ||
| HNO3 – азотная | одноосновная | нитрат |
| H2SO3 – сернистая | двухосновная | сульфит |
| H2SO4 – серная | двухосновная | сульфат |
| H2CO3 – угольная | двухосновная | карбонат |
| H2SiO3 – кремниевая | двухосновная | силикат |
| H3PO4 – ортофосфорная | трёхосновная | ортофосфат |
Получение
- Взаимодействие кислотного оксида с водой (для кислородсодержащих кислот):
SO3 + H2O = H2SO4
P2O5 + 3H2O = 2H3PO4
2. Взаимодействие водорода с неметаллом и последующим растворением полученного продукта в воде (для бескислородных кислот):
H2 + Cl2 = 2HCl
H2 + S = H2S
3. Реакциями обмена соли с кислотой
Ba(NO3)2 + H2SO4 = BaSO4¯ + 2HNO3
в том числе, вытеснение слабых, летучих или малорастворимых кислот из солей более сильными кислотами:
Na2SiO3 + 2HCl = H2SiO3¯ + 2NaCl
2NaCl(тв.) + H2SO4 = Na2SO4 + 2HCl
Химические свойства
- Действие на индикаторы.
лакмус — красный
метилоранж — розовый
2. Взаимодействие с основаниями (реакция нейтрализации):
H2SO4 + 2KOH = K2SO4 + 2H2O
2HNO3 + Ca(OH)2 = Ca(NO3)2 + 2H2O
3. Взаимодействие с основными оксидами:
CuO + 2HNO3 = Cu(NO3)2 + H2O
Взаимодействие с металлами:
Zn + 2HCl = ZnCl2 + H2
2Al + 6HCl = 2AlCl3 + 3H2
(металлы, стоящие в ряду напряжений до водорода, кислоты-неокислители).
4. Взаимодействие с солями (реакции обмена), при которых выделяется газ или образуется осадок:
H2SO4 + BaCl2 = BaSO4¯ +2HCl
2HCl + K2CO3 = 2KCl + H2O + CO2
СОЛИ
Соли — сложные вещества, которые состоят из атомов металла и кислотных остатков. Это наиболее многочисленный класс неорганических соединений.
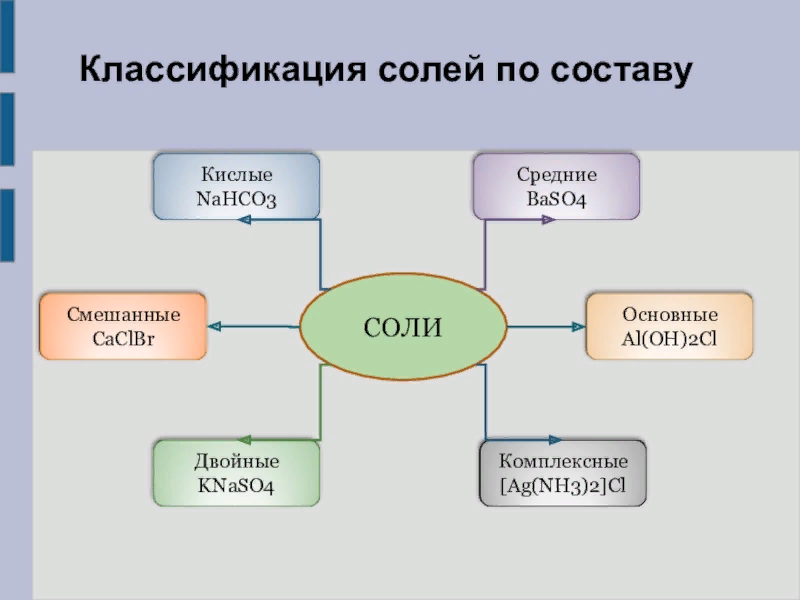
Средние. При диссоциации дают только катионы металла (или NH4+) и анионы кислотного остатка
Na2SO4 = 2Na+ +SO42-
CaCl2 = Ca2+ + 2Cl—
Кислые. При диссоциации дают катионы металла (NH4+), ионы водорода и анионы кислотного остатка.
NaHCO3 = Na+ + HCO3— = Na+ + H+ + CO32-
Продукты неполного замещения атомов водорода многоосновной кислоты на атомы металла.
Основные. При диссоциации дают катионы металла, анионы гидроксила и кислотного остатка.
Zn(OH)Cl = [Zn(OH)]+ + Cl— = Zn2+ + OH— + Cl—
Продукты неполного замещения групп OH соответствующего основания на кислотные остатки.
Двойные. При диссоциации дают два катиона и один анион.
KAl(SO4)2 = K+ + Al3+ + 2SO42-
Смешанные. Образованы одним катионом и двумя анионами:
CaOCl2 = Ca2+ + Cl— + OCl—
Комплексные. Содержат сложные катионы или анионы.
[Ag(NH3)2]Br = [Ag(NH3)2]+ + Br —
Na[Ag(CN)2] = Na+ + [Ag(CN)2]—
Средние соли
Получение
Большинство способов получения солей основано на взаимодействии веществ с противоположными свойствами:
- металла с неметаллом: 2Na + Cl2 = 2NaCl
- металла с кислотой: Zn + 2HCl = ZnCl2 + H2
- металла с раствором соли менее активного металла Fe + CuSO4 = FeSO4 + Cu
- основного оксида с кислотным оксидом:MgO + CO2 = MgCO3
- основного оксида с кислотой CuO + H2SO4 = CuSO4 + H2O
- основания с кислотным оксидом Ba(OH)2 + CO2 = BaCO3¯ + H2O
- основания с кислотой: Ca(OH)2 + 2HCl = CaCl2 + 2H2O
- соли с кислотой: MgCO3 + 2HCl = MgCl2 + H2O + CO2 BaCl2 + H2SO4 = BaSO4¯ + 2HCl
- раствора основания с раствором соли: Ba(OH)2 + Na2SO4 = 2NaOH + BaSO4¯
- растворов двух солей 3CaCl2 + 2Na3PO4 = Ca3(PO4)2¯ + 6NaCl
Кислые соли
Получение
- Взаимодействие кислоты с недостатком основания. KOH + H2SO4 = KHSO4 + H2O
- Взаимодействие основания с избытком кислотного оксида Ca(OH)2 + 2CO2 = Ca(HCO3)2
- Взаимодействие средней соли с кислотой Ca3(PO4)2 + 4H3PO4 = 3Ca(H2PO4)2
Основные соли
Получение
- Гидролиз солей, образованных слабым основанием и сильной кислотой ZnCl2 + H2O = [Zn(OH)]Cl + HCl
- Добавление (по каплям) небольших количеств щелочей к растворам средних солей металлов AlCl3 + 2NaOH = [Al(OH)2]Cl + 2NaCl
- Взаимодействие солей слабых кислот со средними солями 2MgCl2 + 2Na2CO3 + H2O = [Mg(OH)]2CO3¯ + CO2 + 4NaCl
Комплексные соли
Строение
| K4[Fe(CN)6] | |
| K4[Fe(CN)6] | – Внешняя сфера |
| K4[Fe(CN)6] | – Внутренняя сфера |
| K4[Fe(CN)6] | – Комплексообразователь (центральный атом) |
| K4[Fe(CN)6] | – Координационное число |
| K4[Fe(CN)6] | – Лиганд |