Спиртами называются соединения, содержащие одну или несколько гидроксильных групп (–ОН), связанных с углеводородным радикалом. Вещества, у которых гидроксил находится непосредственно у бензольного кольца, называются фенолами.
В зависимости от числа гидроксильных групп спирты делят на одно-, двух- и трёхатомные.
В зависимости от того, при каком углеродном атоме находится гидроксильная группа, различают спирты:
первичные
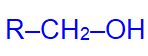
вторичные
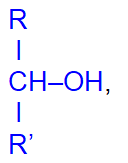
и третичные
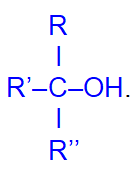
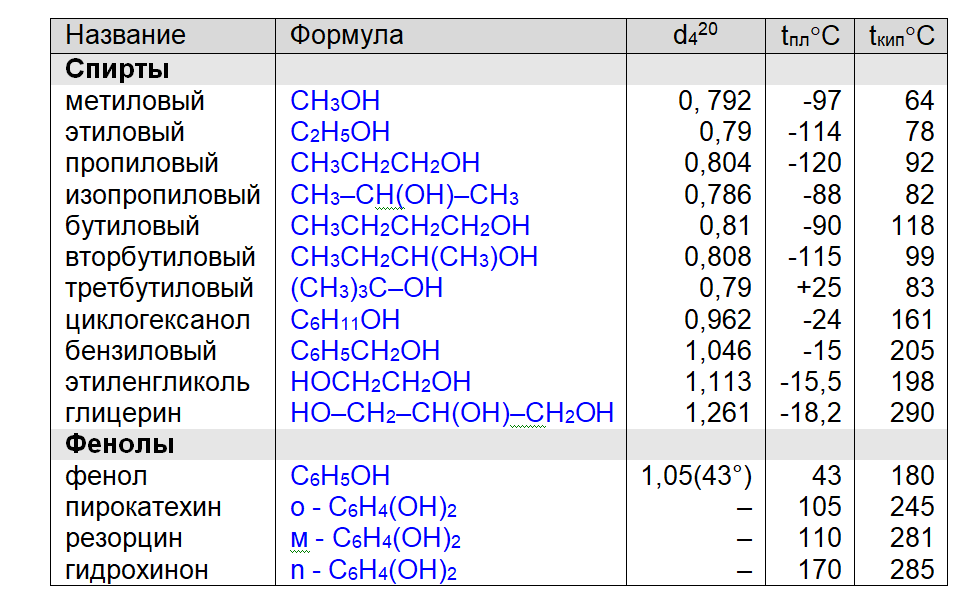
Физические свойства
Низшие спирты (до С12) – жидкости, температуры кипения которых значительно выше, чем у соответствующих алканов из-за образования водородных связей за счёт полярной связи О–Н
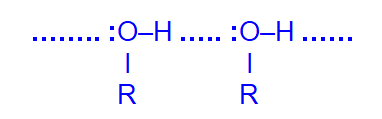
Метанол и этанол смешиваются с водой в любых соотношениях; с увеличением молекулярной массы растворимость спиртов в воде уменьшается.
Таблица. Физические свойства спиртов и фенолов
Одноатомные спирты
Общая формула гомологического ряда предельных одноатомных спиртов – CnH2n+1OH.
Изомерия
- Изомерия углеродного радикала (начиная с C4H9OH).
- Изомерия положения гидроксильной группы, (начиная с С3Н7ОН).
- Межклассовая изомерия с простыми эфирами (СН3–СН2–ОН и СН3–О–СН3).
Название спиртов включает в себя наименование соответствующего углеводорода с добавлением суффикса -ол (положение гидроксильной группы указывают цифрой) или к названию углеводородного радикала добавляется слово «спирт»; также часто встречаются тривиальные (бытовые) названия:
СН3–ОН – метанол, метиловый спирт;
СН3–СН2–ОН – этанол, этиловый спирт;
СН3–СН–СН3 – пропанол-2, изопропиловый спирт.
I
OH
Получение
В промышленности.
- Метанол синтезируют из синтез-газа на катализаторе (ZnO, Сu) при 250°C и давлении 5-10 МПа:
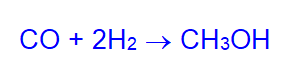
Ранее метанол получали сухой перегонкой древесины без доступа воздуха.
2. Этанол получают:
а) гидратацией этилена (Н3РО4; 280°C; 8 МПа)
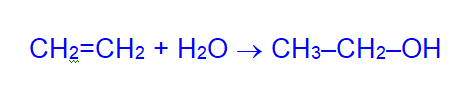
б) брожением крахмала (или целлюлозы):
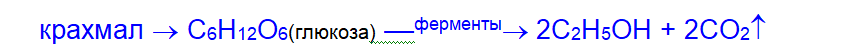
(источник крахмала – зерно, картофель)
В лаборатории.
- Гидратация алкенов (согласно правилу Марковникова):
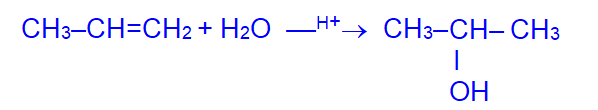
2. Гидролиз галогенопроизводных углеводородов:
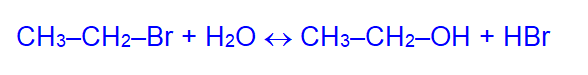
Чтобы сдвинуть равновесие вправо, добавляют щёлочь, которая связывает образующийся HBr.
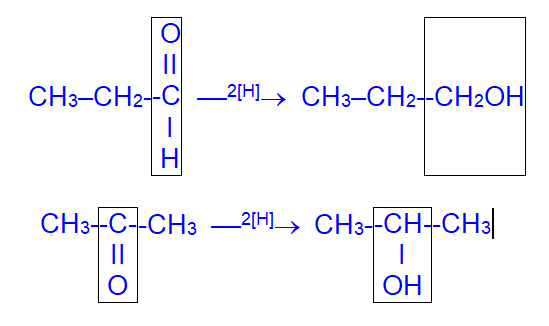
3. Восстановление карбонильных соединений:
Альдегиды образуют первичные спирты, а кетоны – вторичные.
Химические свойства
Свойства спиртов ROH определяются наличием полярных связей Od-–Hd+ и Cd+–Od-,и неподеленных электронных пар на атоме кислорода.

При реакции спиртов возможно разрушение одной из двух связей: C–OH (с отщеплением гидроксильной группы) или O–H (с отщеплением водорода). Это могут быть реакции замещения, в которых происходит замена OH или H, или элиминирование (отщепление), когда образуется двойная связь. На реакционную способность спиртов большое влияние оказывает строение радикалов, связанных с гидроксильной группой.
I. Реакции с разрывом связи RO–H
- Спирты реагируют с щелочными и щелочноземельными металлами, образуя солеобразные соединения – алкоголяты. Со щелочами спирты не взаимодействуют.
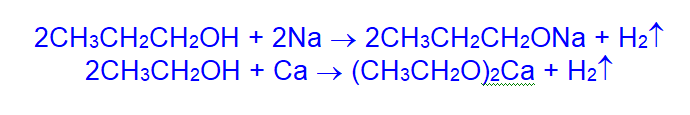
В присутствии воды алкоголяты гидролизуются:
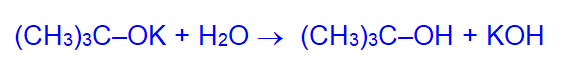
Это означает, что спирты – более слабые кислоты, чем вода.
2. Взаимодействие с органическими кислотами (реакция этерификации) приводит к образованию сложных эфиров.
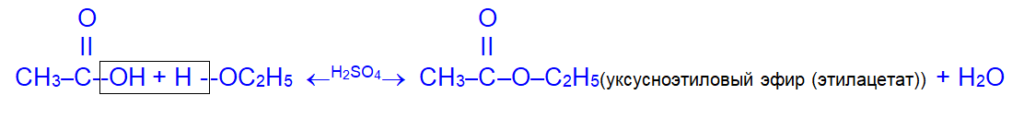
В общем виде:

II. Реакции с разрывом связи R–OH.
- С галогеноводородами:
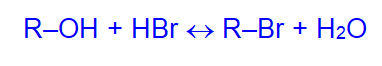
2. С концентрированной серной кислотой:
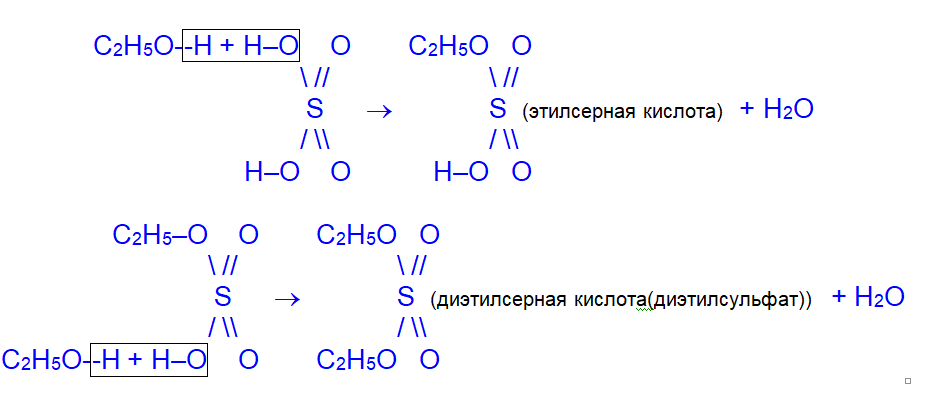
III. Реакции окисления
- Спирты горят:
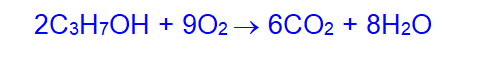
2. При действии окислителей:
а) первичные спирты превращаются в альдегиды (или в карбоновые кислоты)
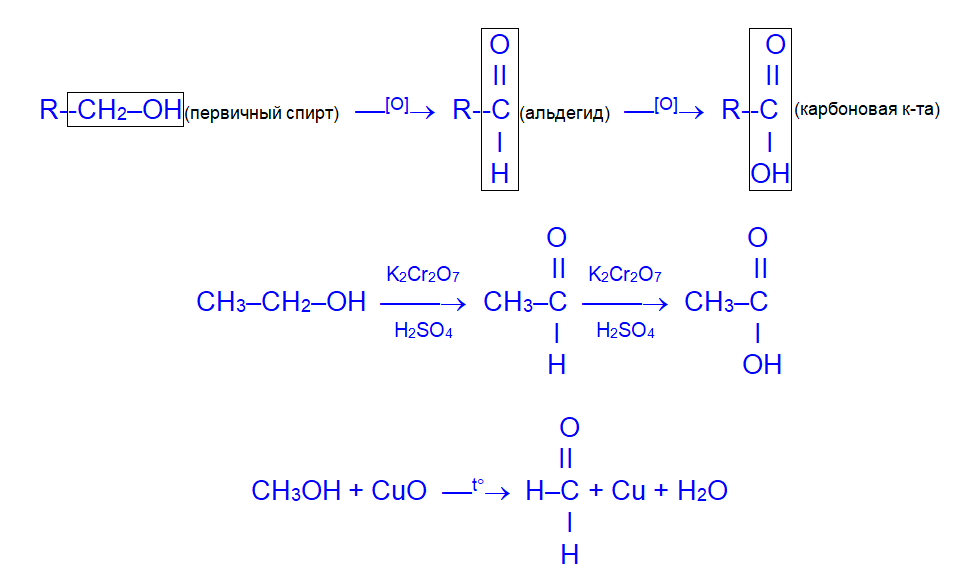
б) вторичные спирты окисляются до кетонов
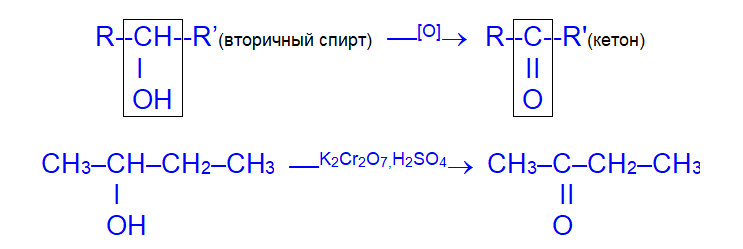
в) третичные спирты устойчивы к действию окислителей.
IV. Дегидратация
Протекает при нагревании с водоотнимающими реагентами.
- Внутримолекулярная дегидратация приводит к образованию алкенов
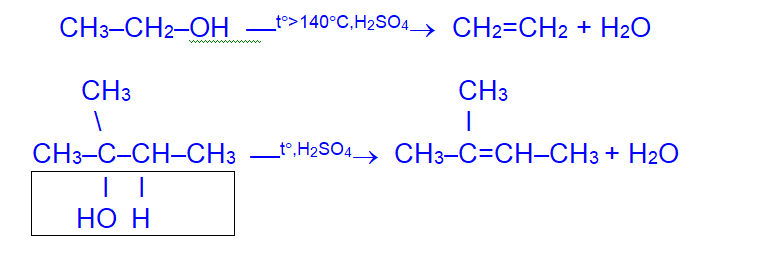
При отщеплении воды от молекул вторичных и третичных спиртов атом водорода отрывается от соседнего наименее гидрогенизированного атома углерода; образующийся алкен содержит наибольшее число заместителей при двойной связи (правило Зайцева).
2. Межмолекулярная дегидратация даёт простые эфиры
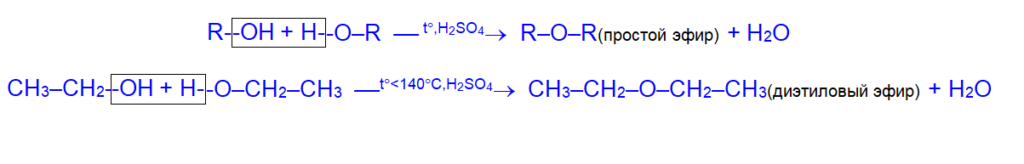
Обе реакции конкурируют между собой. Увеличение температуры и разбавление инертным растворителем благоприятствуют внутримолекулярному процессу.
Многоатомные спирты
Получение
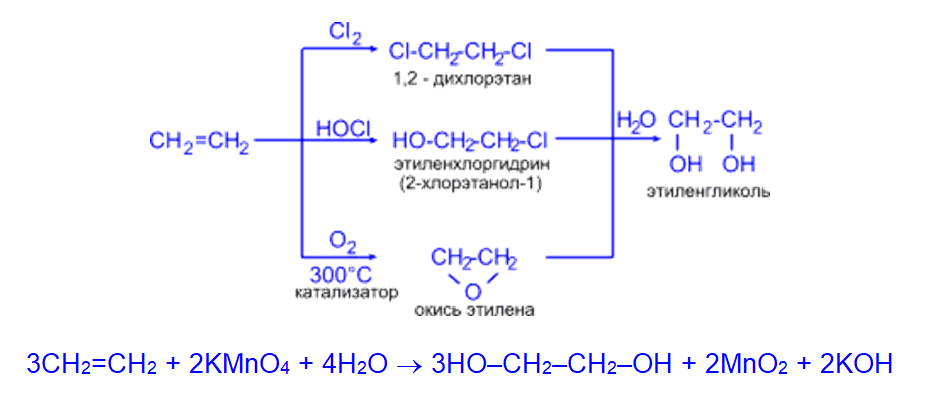
- Этиленгликоль (этандиол-1,2) синтезируют из этилена различными способами:
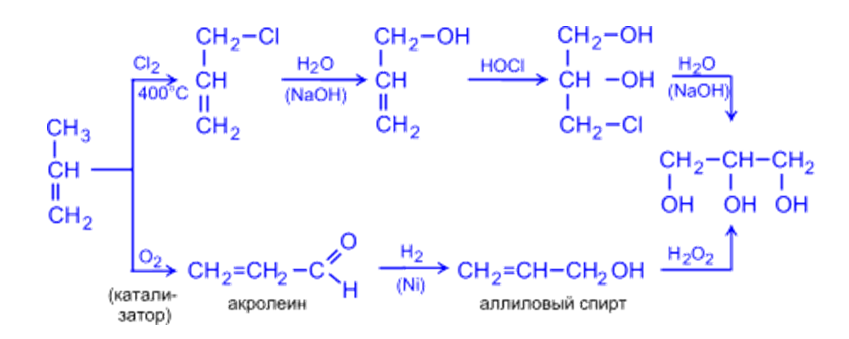
2. Глицерин (пропантриол -1,2,3) получают гидролизом жиров или из пропилена по схемам:
Физические свойства
Этиленгликоль и глицерин – бесцветные, вязкие жидкости, хорошо растворимые в воде, имеют высокие температуры кипения.
Химические свойства
Для многоатомных спиртов характерны основные реакции одноатомных спиртов. В отличие от них, они могут образовывать производные по одной или по нескольким гидроксильным группам, в зависимости от условий проведения реакций.
Многоатомные спирты, как и одноатомные, проявляют свойства кислот при взаимодействии с активными металлами, при этом происходит последовательное замещение атомов водорода в гидроксильных группах.
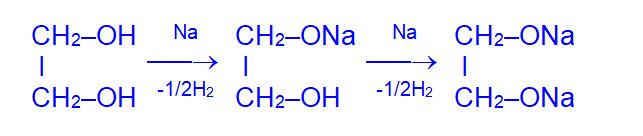
Увеличение числа гидроксильных групп в молекуле приводит к усилению кислотных свойств многоатомных спиртов по сравнению с одноатомными.
Так, они способны растворять свежеосаждённый гидроксид меди (II) с образованием внутрикомплексных соединений:
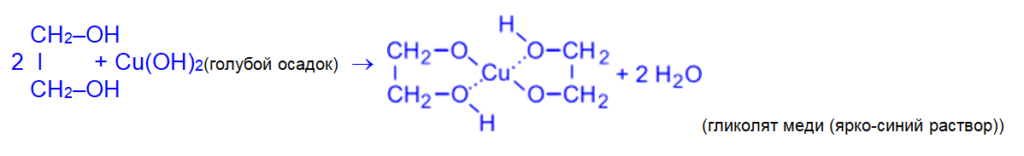
(одноатомные спирты с Cu(OH)2 не реагируют).
Глицерин легко нитруется, давая тринитроглицерин – сильное взрывчатое вещество (основа динамита):
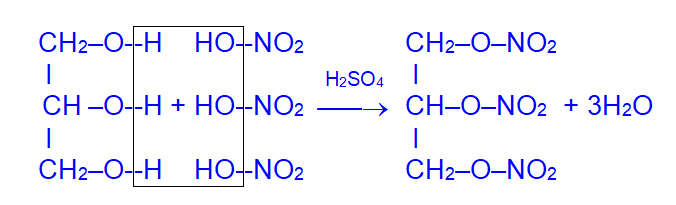
При его взрыве выделяется большое количество газов и тепла:
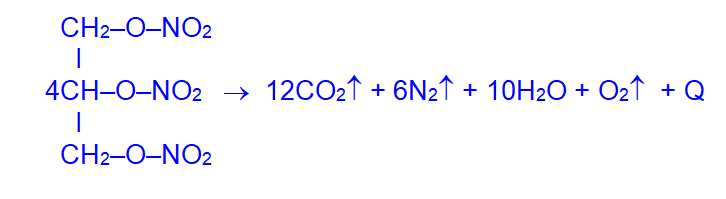
Применение
Этиленгликоль применяют:
- в качестве антифриза;
- для синтеза высокомолекулярных соединений (например, лавсана).
Глицерин применяют:
- в парфюмерии и в медицине (для изготовления мазей, смягчающих кожу);
- в кожевенном производстве и в текстильной промышленности;
- для производства нитроглицерина.