Общие свойства металлов
Виды кристаллических решеток
Существуют три типа кристаллических решеток: атомная, ионная и металлическая.
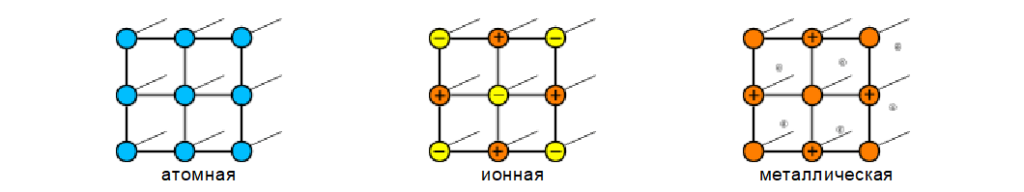
Кристаллические решетки металлического типа содержат в узлах положительно заряженные ионы и нейтральные атомы; между ними передвигаются относительно свободные электроны.
Общие физические свойства
Объясняются особым строением кристаллической решетки — наличием свободных электронов («электронного газа»).
Пластичность — способность изменять форму при ударе, вытягиваться в проволоку, прокатываться в тонкие листы. В ряду ––Au,Ag,Cu,Sn,Pb,Zn,Fe ->уменьшается.

Блеск, обычно серый цвет и непрозрачность. Это связано со взаимодействием свободных электронов с падающими на металл квантами света.

Электропроводность.
Объясняется направленным движением свободных электронов от отрицательного полюса к положительному под влиянием небольшой разности потенциалов. В ряду ––Ag,Cu,Al,Fe-> уменьшается.
При нагревании электропроводность уменьшается, т.к. с повышением температуры усиливаются колебания атомов и ионов в узлах кристаллической решетки, что затрудняет направленное движение «электронного газа».

Теплопроводность. Обусловлена высокой подвижностью свободных электронов и колебательным движением атомов, благодаря чему происходит быстрое выравнивание температуры по массе металла. Наибольшая теплопроводность — у висмута и ртути.
Твердость. Самый твердый – хром (режет стекло); самые мягкие – щелочные металлы – калий, натрий, рубидий и цезий – режутся ножом.
Плотность. Она тем меньше, чем меньше атомная масса металла и чем больше радиус его атома (самый легкий — литий (ρ = 0,53 г/см3); самый тяжелый – осмий (ρ = 22,6 г/см3).
Металлы, имеющие ρ < 5 г/см3 считаются «легкими металлами».
Температуры плавления и кипения. Самый легкоплавкий металл – ртуть (t пл = -39°C), самый тугоплавкий металл – вольфрам (t пл = 3390°C).
Металлы с t°пл. выше 1000°C считаются тугоплавкими, ниже – низкоплавкими.
Общие химические свойства металлов
Сильные восстановители: Meo – nē = Men+
I. Реакции с неметаллами
С кислородом:
2Mgо + O2о = 2MgО
С серой:
Hgo + Sо = HgS
С галогенами:
Niо + Cl2о – t°> NiCl2
С азотом:
3Caо + N2о – t°> Ca3N2
С фосфором:
3Cao + 2Pо – t°> Ca3P2
С водородом (реагируют только щелочные и щелочноземельные металлы):
2Liо + H2о = 2LiH
Caо + H2о = CaH2
II. Реакции с кислотами
Металлы, стоящие в электрохимическом ряду напряжений до H восстанавливают кислоты-неокислители до водорода:
Mgо + 2HCl = MgCl2 + H2о
2Alо+ 6HCl = 2AlCl3 + 3H2о
6Naо + 2H3PO4 = 2Na3PO4 + 3H2о
Восстановление металлами кислот-окислителей смотри в разделах: «окислительно-восстановительные реакции», «серная кислота», «азотная кислота».
III. Взаимодействие с водой
Активные (щелочные и щелочноземельные металлы) образуют растворимое основание и водород:
2Naо + 2H2O = 2NaOH + H2о
Caо + 2H2O = Ca(OH)2 + H2о
Металлы средней активности окисляются водой при нагревании до оксида:
Znо + H2O –> ZnО + H2о
Неактивные (Au, Ag, Pt) — не реагируют.
IV. Вытеснение более активными металлами менее активных металлов из растворов их солей:
Cuо + HgCl2 = Hgо + CuCl2
Feо + CuSO4 = Cuо + FeSO4
Задачи:
1. Железо массой 11,2 г сплавили с серой массой 6,4 г. К продукту реакции прилили соляную кислоту (взята в избытке). Выделившийся газ пропустили через раствор сульфата меди (II). Рассчитайте массу полученного осадка.
2. Вычислите объем соляной кислоты (массовая доля HCl 20%, плотность 1,1 г/мл), которая потребуется для растворения смеси цинка и никеля массой 9,8 г (массовая доля никеля в смеси составляет 60,2%).
3. Методом электронного баланса подберите коэффициенты в схемах следующих окислительно-восстановительных реакций с участием металлов:
a) Sn + KOH + H2O → K2[Sn(OH)4] + Н2
6) Ag + HNO3 → AgNO3 + NO + H2O
в) Ca + Н2SO4 → CaSO4 + H2S + H2O
г) Bi+HNO3 → Bi (NO3)3 + NO + H2O
4. Технический цинк массой 0,33 г обработали разбавленным раствором серной кислоты. Выделившийся водород занимает при нормальных условиях объем 112 мл.
Рассчитайте массовую долю цинка в техническом металле.
5. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
a) CuSO4 → Cu → Cu(NO3)2 → Cu(OH)2
б) Cu (OH)2 → CuO → CuCl2 → CuS
Уравнения реакций, протекающих в водных растворах электролитов, изобразите в молекулярной и сокращенной ионной формах.
6. Кобальт массой 2,95 г растворили в соляной кислоте, при этом образуется соль кобальта (II), в
полученный раствор пропустили сероводород. Определите массу образующегося при этом осадка.
7. Изобразите электронные формулы атомов титана (элемент № 22) и галлия (№ 31). Укажите, какие
электроны отдают атомы, образуя химические соединения. Какие степени окисления они проявляют при этом?
8. Германий и свинец находятся в главной подгруппе четвертой группы периодической системы
Д. И. Менделеева. Какой из этих металлов проявляет более выраженные металлические свойства?
9. Смесь меди и оксида меди (II) массой 2 г растворили в концентрированной серной кислоте. При этом образовался газ объемом 0,56 л (нормальные условия). Вычислите массу оксида меди в исходной смеси.
10. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
MnO2 → MnCl2 — Мп — MnSO4 — Mn(OH)2