Растворы — однородная многокомпонентная система, состоящая из растворителя, растворённых веществ и продуктов их взаимодействия.

По агрегатному состоянию растворы могут быть жидкими (морская вода), газообразными (воздух) и твёрдыми (многие сплавы металлов).

Размеры частиц в истинных растворах — менее 10-9 м (порядка размеров молекул).
По количеству растворённого вещества растворы подразделяются на ненасыщенные, насыщенные и перенасыщенные.
Если молекулы или ионы, распределённые в растворе присутствуют в нём в таком количестве, что при данных условиях не происходит дальнейшего растворения вещества, то такой раствор называется насыщенным. (Например, если поместить 50 г NaCl в 100 г H2O, то при 20ºC растворится только 36 г соли).
Насыщенным называется раствор, который находится в динамическом равновесии с избытком растворённого вещества.

Если растворить в воде вещества меньше чем насыщенном, то получим ненасыщенный раствор. Растворив 20 г NaCl в 100 г воды, получим ненасыщенный раствор поваренной соли в воде.
Ненасыщенный раствор — раствор, содержащий меньше вещества, чем в насыщенном.
При нагревании смеси соли с водой до 100°C произойдёт растворение 39,8 г NaCl в 100 г воды. Если теперь удалить из раствора нерастворившуюся соль, а раствор осторожно охладить до 20ºC, избыточное количество соли не всегда выпадает в осадок. В этом случае мы имеем дело с перенасыщенным раствором. Перенасыщенные растворы очень неустойчивы. Помешивание, встряхивание, добавление крупинок соли может вызвать кристаллизацию избытка соли и переход в насыщенное устойчивое состояние.
Перенасыщенный раствор — раствор, содержащий больше вещества, чем в насыщенном.
Растворение как физико-химический процесс
Растворы образуются при взаимодействии растворителя и растворённого вещества. Процесс взаимодействия растворителя и растворённого вещества называется сольватацией (если растворителем является вода — гидратацией).
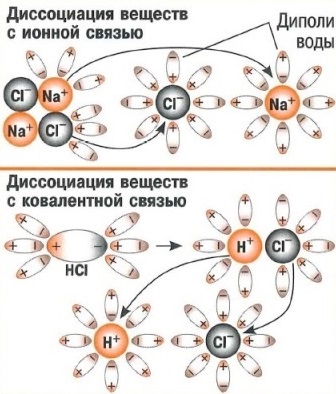
Растворение протекает с образованием различных по форме и прочности продуктов — гидратов. При этом участвуют силы как физической, так и химической природы. Процесс растворения вследствие такого рода взаимодействий компонентов сопровождается различными тепловыми явлениями.
Энергетической характеристикой растворения является теплота образования раствора, рассматриваемая как алгебраическая сумма тепловых эффектов всех эндо- и экзотермических стадий процесса. Наиболее значительными среди них являются:
– поглощающие тепло процессы — разрушение кристаллической решётки, разрывы химических связей в молекулах;
– выделяющие тепло процессы — образование продуктов взаимодействия растворённого вещества с растворителем (гидраты) и др.
Если энергия разрушения кристаллической решетки меньше энергии гидратации растворённого вещества, то растворение идёт с выделением теплоты (наблюдается разогревание). Так, растворение NaOH – экзотермический процесс: на разрушение кристаллической решётки тратится 884 кДж/моль, а при образовании гидратированных ионов Na+ и OH— выделяется соответственно 422 и 510 кДж/моль.
Если энергия кристаллической решётки больше энергии гидратации, то растворение протекает с поглощением теплоты (при приготовлении водного раствора NH4NO3 наблюдается понижение температуры).
Растворимость
Предельная растворимость многих веществ в воде и других растворителях — это постоянная величина, которая соответствует концентрации насыщенного раствора при определенной температуре. Она служит количественной характеристикой растворимости и обычно указывается в справочниках в граммах на 100 граммов растворителя при конкретных условиях.
Растворимость зависит от природы растворяемого вещества и растворителя, температуры и давления.
Природа растворяемого вещества. Кристаллические вещества подразделяются на:
Р — хорошо растворимые (более 1,0 г на 100 г воды);
M — малорастворимые (0,1 г — 1,0 г на 100 г воды);
Н — нерастворимые (менее 0,1 г на 100 г воды).
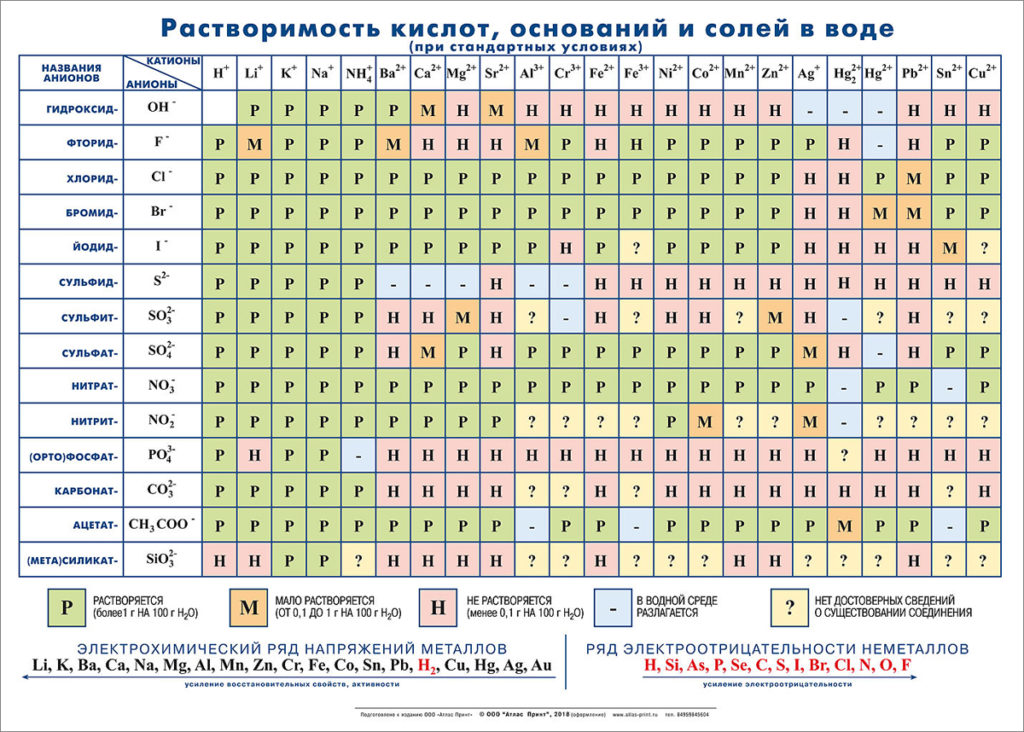
Природа растворителя. При образовании раствора связи между частицами каждого из компонентов заменяются связями между частицами разных компонентов. Чтобы новые связи могли образоваться, компоненты раствора должны иметь однотипные связи, т.е. быть одной природы. Поэтому ионные вещества хорошо растворяются в полярных растворителях и плохо в неполярных, а молекулярные вещества — наоборот.
Влияние температуры. Если растворение вещества является экзотермическим процессом, то с повышением температуры его растворимость уменьшается (Например,Ca(OH)2 в воде) и наоборот. Для большинства солей характерно увеличение растворимости при нагревании.
Практически все газы растворяются с выделением тепла. Растворимость газов в жидкостях с повышением температуры уменьшается, а с понижением увеличивается.
КОНЦЕНТРАЦИЯ РАСТВОРОВ
Способы выражения концентрации растворов
Существуют различные способы выражения состава раствора. Наиболее часто используют массовую долю растворённого вещества, молярную и нормальную концентрацию.
Массовая доля растворённого вещества w(B) — это безразмерная величина, равная отношению массы растворённого вещества к общей массе раствора m :
w(B)= m(B) / m
Массовую долю растворённого вещества w(B) обычно выражают в долях единицы или в процентах. Например, массовая доля растворённого вещества – CaCl2 в воде равна 0,06 или 6%. Это означает,что в растворе хлорида кальция массой 100 г содержится хлорид кальция массой 6 г и вода массой 94 г.
Пример
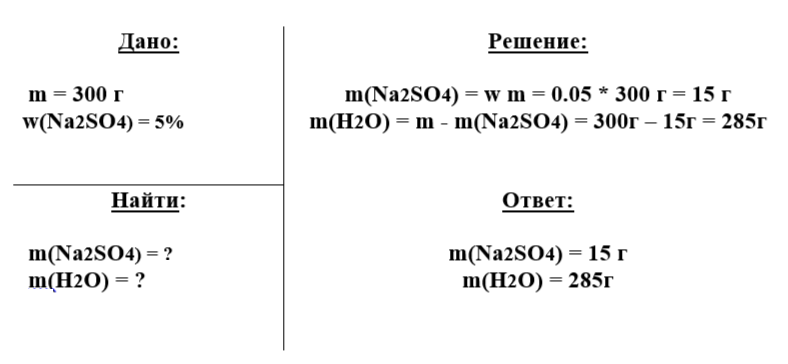
Сколько грамм сульфата натрия и воды нужно для приготовления 300 г 5% раствора?
Молярная концентрация C(B) показывает, какое количество растворённого вещества содержится в 1 литре раствора.
C(B) = n(B) / V = m(B) / (M(B) • V),
где М(B) — молярная масса растворенного вещества г/моль.
Молярная концентрация измеряется в моль/л и обозначается «M». Например, 2 M NaOH — двухмолярный раствор гидроксида натрия. Один литр такого раствора содержит 2 моль вещества или 80 г (M(NaOH) = 40 г/моль).
Пример
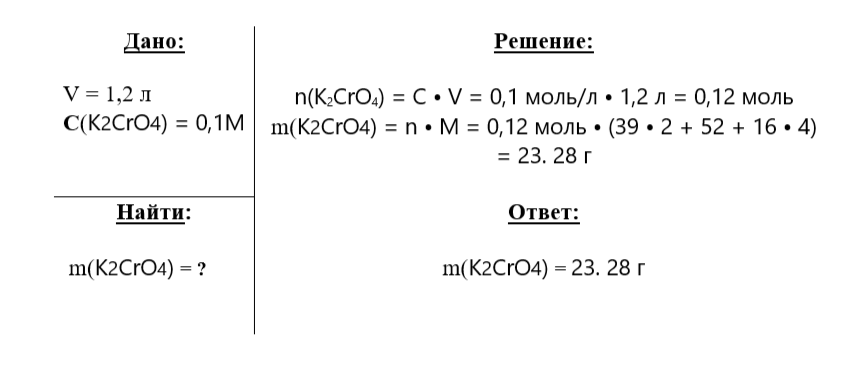
Какую массу хромата калия K2CrO4 нужно взять для приготовления 1,2 л 0,1 М раствора?
Концентрацию раствора можно выразить количеством молей растворённого вещества в 1000 г растворителя. Такое выражение концентрации называют моляльностью раствора.
Нормальность раствора обозначает число грамм-эквивалентов данного вещества в одном литре раствора или число миллиграмм-эквивалентов в одном миллилитре раствора.
Грамм — эквивалентом вещества называется количество граммов вещества, численно равное его эквиваленту. Для сложных веществ — это количество вещества, соответствующее прямо или косвенно при химических превращениях 1 грамму водорода или 8 граммам кислорода.
Эоснования = Моснования / число замещаемых в реакции гидроксильных групп
Экислоты = Мкислоты / число замещаемых в реакции атомов водорода
Эсоли = Мсоли / произведение числа катионов на его заряд
Пример
Вычислите значение грамм-эквивалента (г-экв.) серной кислоты, гидроксида кальция и сульфата алюминия.
Э H2SO4 = М H2SO4 / 2 = 98 / 2 = 49 г
Э Ca(OH)2 = М Ca(OH)2 / 2 = 74 / 2 = 37 г
Э Al2(SO4)3 = М Al2(SO4)3 / (2 • 3) = 342 / 6 = 57 г
Величины нормальности обозначают буквой «Н». Например, децинормальный раствор серной кислоты обозначают «0,1 Н раствор H2SO4«. Так как нормальность может быть определена только для данной реакции, то в разных реакциях величина нормальности одного и того же раствора может оказаться неодинаковой. Так, одномолярный раствор H2SO4 будет однонормальным, когда он предназначается для реакции со щёлочью с образованием гидросульфата NaHSO4, и двухнормальным в реакции с образованием Na2SO4.
Пример
Рассчитайте молярность и нормальность 70%-ного раствора H2SO4 (ρ = 1,615 г/мл).
Решение
Для вычисления молярности и нормальности надо знать число граммов H2SO4 в 1 л раствора. 70% -ный раствор H2SO4 содержит 70 г H2SO4 в 100 г раствора. Это весовое количество раствора занимает объём
V = 100 / 1,615 = 61,92 мл
Следовательно, в 1 л раствора содержится 70 • 1000 / 61,92 = 1130,49 г H2SO4
Отсюда молярность данного раствора равна: 1130,49 / М (H2SO4) =1130,49 / 98 =11,53 M
Нормальность этого раствора (считая, что кислота используется в реакции в качестве двухосновной) равна 1130,49 / 49 =23,06 H
Задачи:
- Определите массовую долю гидроксида бария в растворе, полученном при смешении воды массой 50 г и оксида бария массой 1,2 г.
- Какая масса цинка может прореагировать с соляной кислотой объемом 50 мл и плотностью 1,1 г/мл, массовая доля НСІ в котором составляет 0,2? Какой объем водорода, измеренный при нормальных условиях, выделится при этом?
- Какое количество вещества хлорида серебра может быть получено при смешении раствора объемом 120 мл с массовой долей НСІ 10% и плотностью 1,05 г/мл с раствором 0,5M AgNO3 объемом 200 мл?
- Определите объем раствора 1,2M NaOH, который потребуется для полного осаждения железа в виде гидроксида из раствора массой 300 г с массовой долей хлорида железа (ІІІ) 12%.
- Какой объем раствора 1,6М HCl необходим для нейтрализации кристаллической соды Na2CO3 * 10Н2О массой 57,2 г?