
«Свойства элементов, а потому и образуемых ими простых и сложных тел (веществ), стоят в периодической зависимости от их атомного веса».
Современная формулировка:
«Свойства химических элементов (т.е. свойства и форма образуемых ими соединений) находятся в периодической зависимости от заряда ядра атомов химических элементов».
Физический смысл химической периодичности
Периодические изменения свойств химических элементов обусловлены правильным повторением электронной конфигурации внешнего энергетического уровня (валентных электронов) их атомов с увеличением заряда ядра.
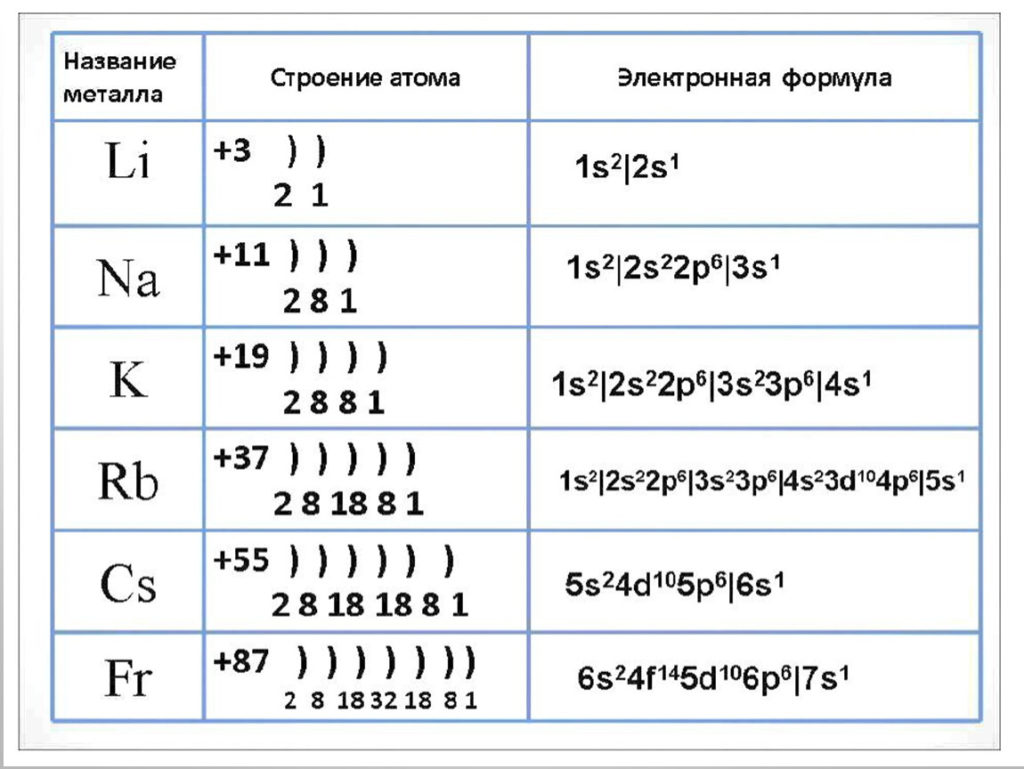
Графическим изображением периодического закона является периодическая таблица. Она содержит 7 периодов и 8 групп.
Период — горизонтальный ряд элементов с одинаковым максимальным значением главного квантового числа валентных электронов.
Номер периода определяет число энергетических уровней в атоме элемента.
Все периоды (кроме первого) начинаются щелочным металлом (s-элементом), а заканчиваются благородным газом (ns2 np6).
Периоды могут состоять из 2 (первый), 8 (второй и третий), 18 (четвертый и пятый) или 32 (шестой) элементов, в зависимости от количества электронов на внешнем энергетическом уровне. Последний, седьмой период незавершен.
Металлические свойства рассматриваются, как способность атомов элементов легко отдавать электроны, а неметаллические — присоединять электроны, так как атомы при образовании химической связи стремятся приобрести устойчивую конфигурацию с заполненными подуровнями. Заполнение внешнего s- подуровня указывает на металлические свойства атома, а формирование внешнего p- подуровня — на неметаллические свойства. Увеличение числа электронов на p- подуровне (от 1 до 5) усиливает неметаллические свойства атома. Атомы с полностью сформированной, энергетически устойчивой конфигурацией внешнего электронного слоя (ns2 np6) химически инертны.
В больших периодах переход свойств от активного металла к благородному газу происходит более плавно, чем в малых периодах, т.к. происходит формирование внутреннего (n — 1) d- подуровня при сохранении внешнего ns2 — слоя. Большие периоды состоят из четных и нечетных рядов.
У элементов четных рядов на внешнем слое ns2 — электроны, поэтому преобладают металлические свойства и их ослабление с ростом заряда ядра невелико; в нечетных рядах формируется np- подуровень, что объясняет значительное ослабление металлических свойств.
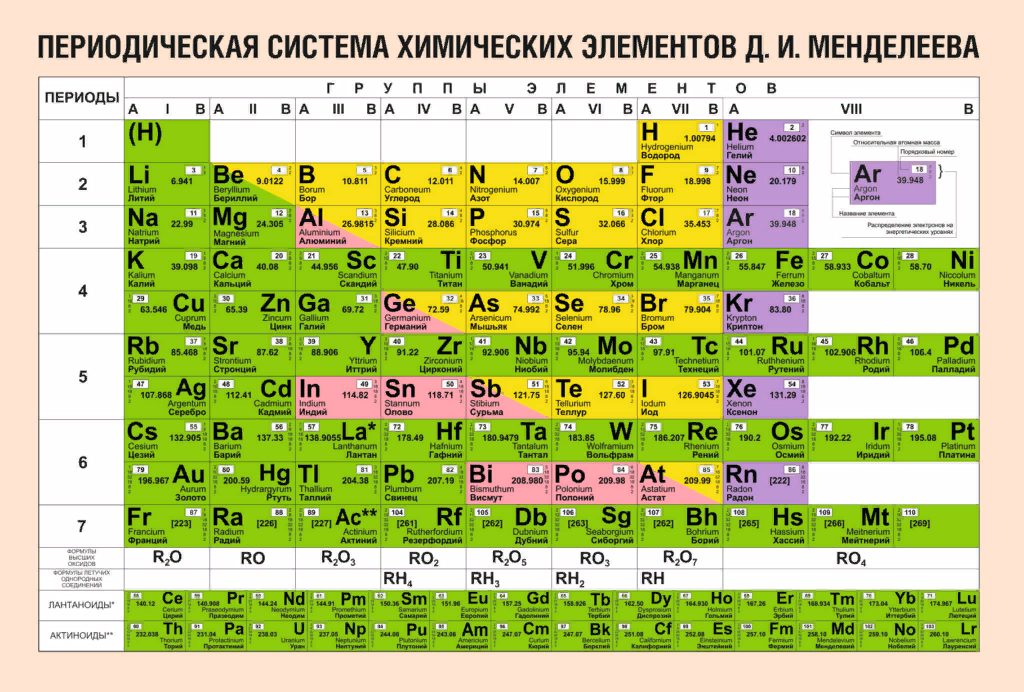
Группы — вертикальные столбцы элементов с одинаковым числом валентных электронов, равным номеру группы. Различают главную и побочную подгруппы.
Главные подгруппы состоят из элементов малых и больших периодов, валентные электроны которых расположены на внешних ns- и np- подуровнях.
Побочные подгруппы состоят из элементов только больших периодов. Их валентные электроны находятся на внешнем ns- подуровне и внутреннем (n — 1) d- подуровне (или (n — 2) f- подуровне).
В зависимости от того, какой подуровень (s-, p-, d- или f-) заполняется валентными электронами, элементы периодической системы подразделяются на: s- элементы (элементы главной подгруппы I и II групп), p- элементы (элементы главных подгрупп III — VII групп), d- элементы (элементы побочных подгрупп), f- элементы (лантаноиды, актиноиды).
В главных подгруппах сверху вниз металлические свойства усиливаются, а неметаллические ослабевают. Элементы главных и побочных групп сильно отличаются по свойствам.
Номер группы показывает высшую валентность элемента (кроме O, F, элементов подгруппы меди и восьмой группы).
Общими для элементов главных и побочных подгрупп являются формулы высших оксидов (и их гидратов). У высших оксидов и их гидратов элементов I — III групп (кроме бора) преобладают основные свойства, с IV по VIII — кислотные.
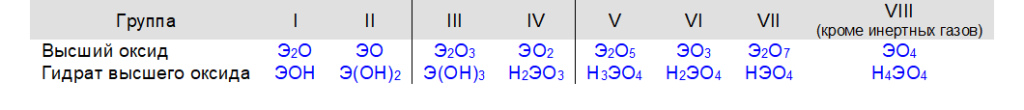
Для элементов главных подгрупп общими являются формулы водородных соединений. Элементы главных подгрупп I — III групп образуют твердые вещества — гидриды (водород в степени окисления — 1), а IV — VII групп — газообразные. Водородные соединения элементов главных подгрупп IV группы (ЭН4) — нейтральны, V группы (ЭН3) — основания, VI и VII групп (Н2Э и НЭ) — кислоты.
От положения элементов в периодической системе зависят свойства атома, связанные с его электронной конфигурацией: атомный радиус — по периоду слева направо уменьшается, а в подгруппе сверху вниз возрастает; энергия ионизации — по периоду возрастает, а в подгруппе уменьшается; электроотрицательность — по периоду увеличивается, а в подгруппе уменьшается.
По положению элемента в периодической системе можно прогнозировать его основные свойства как средние всех его соседей:
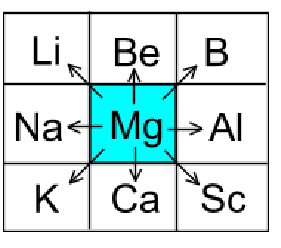
Пример
На основании периодической таблицы охарактеризуйте химические элементы с порядковыми номерами 21 и 34.
Для характеристики химического элемента по периодической системе Д.И.Менделеева следует рассмотреть:
- Положение в периодической таблице (порядковый номер; период, ряд; группа, подгруппа; атомная масса).
- Строение атома (заряд ядра; состав ядра — количество протонов p11, нейтронов n01 и электронов ē; число энергетических уровней и подуровней; написать формулу электронной конфигурации; квантовые ячейки; по числу и характеру валентных электронов определить тип элемента).
- Формулы и химический характер соединений (высшего оксида и гидроксида; водородных соединений).Сравнить с соседями (по периоду, по группе).
Порядковый номер элемента Z = 21 обозначает: заряд ядра атома элемента (скандия): 6521Sc – +21; число протонов p11: 21Sc – 21 p11; число электронов ē: 21Sc – 21ē; число нейтронов n01 = Ar – Z = 45 – 21 = 24n10
Формула состава атома

Скандий находится в IV периоде; номер периода обозначает число энергетических уровней — 4.
Скандий расположен в побочной подгруппе. Следовательно, его валентные электроны будут находится на 4s- и 3d-подуровнях.
Электронная формула скандия

или в виде сокращенной записи: [Ar] 3d14s2
Электронная формула в виде квантовых ячеек:
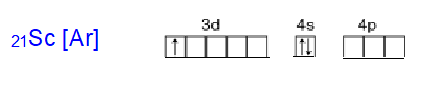
Скандий – d- элемент. Электронное строение атома заканчивается s- электронами, поэтому элемент будет проявлять металлические свойства.
Формула высшего оксида – Sc2O3, гидроксида – Sc(OH)3 обладают слабыми основными свойствами. Соединений с водородом не образует.
Порядковый номер 34 имеет селен Se. Элемент находится в IV периоде, значит в атоме имеется 4 энергетических уровня. Он находится в главной подгруппе VI группы; его валентные электроны распределены на 4s и 4p-подуровнях.
Электронная формула селена:
34Se 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p4
Электронная конфигурация в виде квантовых ячеек имеет вид:

Атом селена имеет 6 валентных электронов; поэтому высшая валентность равна 6, что соответствует номеру группы.
Селен — p- элемент, поэтому будет проявлять свойства неметалла.
Высший оксид SeO3, его гидроксид H2SeO4 и газообразное водородное соединение H2Se имеют кислотный характер.