“Химия металлов. Свойства соединений марганца и железа.
Цель работы: исследование свойств соединений марганца и железа.
Для работы необходимо: штатив с пробирками; растворы серной кислоты H2SO4, гидроксида натрия NаОН, перманганата калия КМnО4; хлорида железа (III) FеСl3, гексацианоферрата (III) калия К3[Fe(СN)6], тиоцианата аммония NН4SCN, сульфита натрия Nа2SO3; и сульфат железа (II) FеSО4.
Опыт №1 Окислительные свойства перманганатов. Влияние среды на характере протекания окислительно — восстановительных реакций.
Реакции окисления -восстановления могут протекать в разных средах: кислой (избыток иона Н+), нейтральной (Н2О) и щелочной (избыток гидроксид — ионов ОН—). В зависимости от среды может изменяться характер протекания реакций между одними и теми же веществами. Среда влияет на изменение степени окисления атомов. Рассмотрим в качестве примера восстановление перманганат — иона МnО4—, которое можно представить данной схемой:
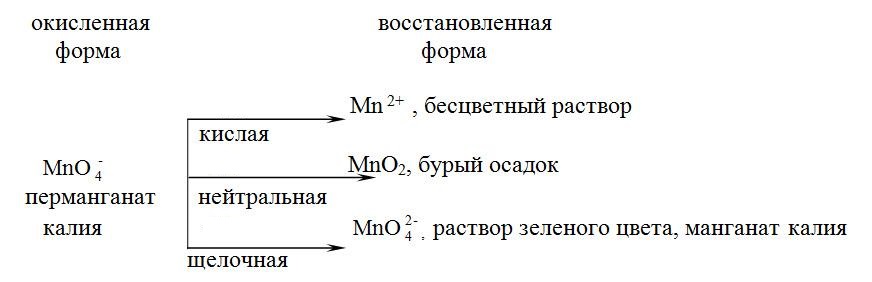
Выполнение опыта.
В три пробирки налейте по 1-2мл раствора перманганата калия КМnО4. Создайте разную среду для реакций путем добавления по 0,5-1 мл: в первую пробирку серной кислоты H2SO4, во вторую — воды, в третью — гидроксида натрия NаОН, После этого в каждую пробирку добавьте по несколько капель сульфита натрия Nа2SO3. Наблюдайте за изменением окраски растворов.
Запись результатов опыта.
Напишите уравнения реакций.
1) Nа2SO3 + КМnО4 + H2SO4 ->Nа2SO4 + МnSO4 + K2SO4 + H2O
2) Nа2SO3 + КМnО4 + H2O -> Nа2SO4+ МnO2 + КОН
3) Nа2SO3 + КМnО4 + NаОН -> Nа2SO4 + К2МnО4 + Nа2МnО4+H2O
Подберите коэффициенты в каждом уравнении методом электронного баланса.
Укажите окислитель и восстановитель.
Опыт №2 Качественная ‚еак ия на ионы железа Fе2+ и Fе3+
Ионы железа Fе2+ и Fе3+ дают с гексацианоферратом (III) калия К3[Fe(СN)6] и тиоцианатом аммония NН4SCN характерно окрашенные соединения, по которым можно определить их присутствие в растворе.
Выполнение опыта.
1. В пробирку налейте 2-3мл раствора сульфата железа(II) FеSО4. К раствору FеSО4, добавьте 2-3 капли раствора гексацианоферрата (III) калия К3[Fe(СN)6]. При этом образуется темно — синий осадок комплексного соединения железа (II), который называется турнбулевой синью:
3FеSО4+ 2К3[Fe(СN)6] = Fe3[Fe(СN)6]2 +3К2SО4
2. В пробирку налейте раствор хлорида железа (III) FеСl3 (2-3мл). Добавьте 2-3 капли тиоцианата аммония NН4SCN. Наблюдайте появление характерной кроваво — красной окраски раствора, которую ему придает образующийся тиоцианат (III) Fe(SCN)3.
FеСl3 + NН4SCN -> Fe(SCN)3 +NН4Сl
Запись результатов опыта. Напишите уравнение первой реакции в молекулярной, полной ионной и сокращенной ионной формах. Напишите уравнение второй реакции в молекулярной форме, расставьте коэффициенты.