Карбоновыми кислотами называются производные углеводородов, в молекуле которых содержится одна или несколько карбоксильных групп –COOH.
Общая формула карбоновых кислот:
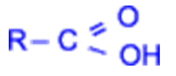
В зависимости от природы радикала, связанного с карбоксильной группой, кислоты подразделяются на предельные, непредельные и ароматические
Число карбоксильных групп определяет основность кислот.
Общая формула предельных одноосновных кислот: СnH2n+1COOH (или СnH2nO2).
Номенклатура. Распространены тривиальные названия. По правилам IUPAC к названию углеводорода добавляют «-овая кислота».
Изомерия.
- Для алифатических кислот — изомеризация углеводородного радикала.
- Для ароматических — изомерия положения заместителя при бензольном кольце.
- Межклассовая изомерия со сложными эфирами (например, CH3COOH и HCOOCH3).
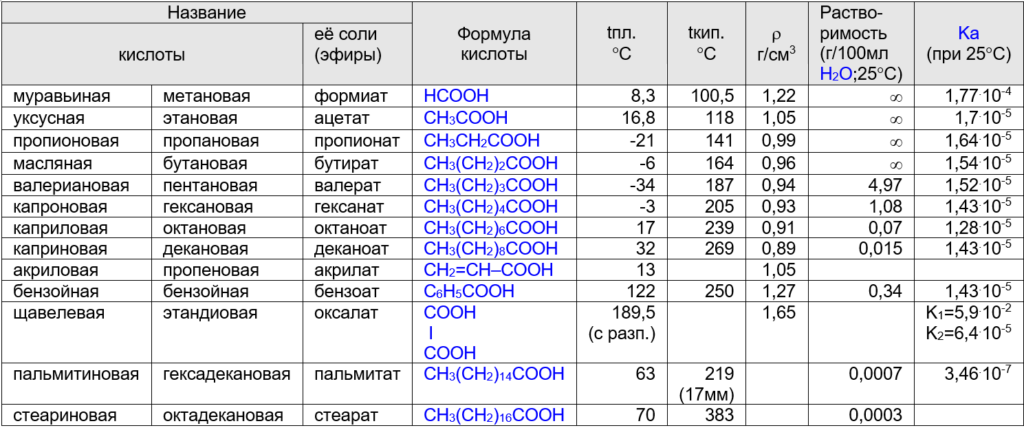
Таблица. Основные карбоновые кислоты (номенклатура, физические свойства)
Получение
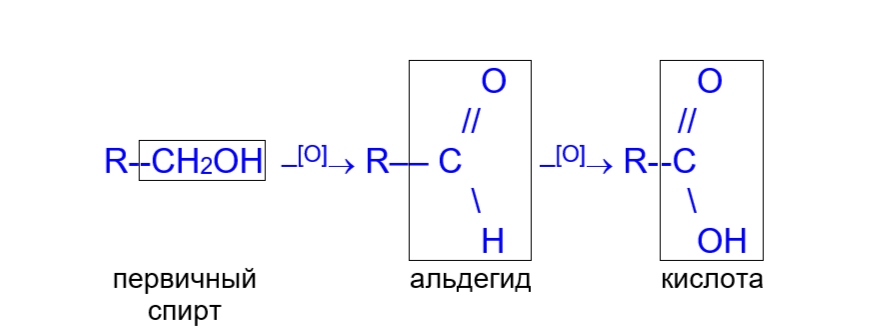
- Окисление первичных спиртов и альдегидов (кислородом на катализаторе; KMnO4; K2Cr2O7):
2. Промышленный синтез муравьиной кислоты:
a) каталитическое окисление метана
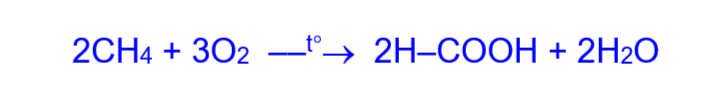
б) нагреванием оксида углерода (II) c гидроксидом натрия

3. Промышленный синтез уксусной кислоты:
а) каталитическое окисление бутана

б) нагреванием смеси оксида углерода (II) и метанола на катализаторе под давлением
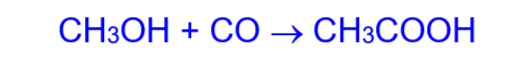
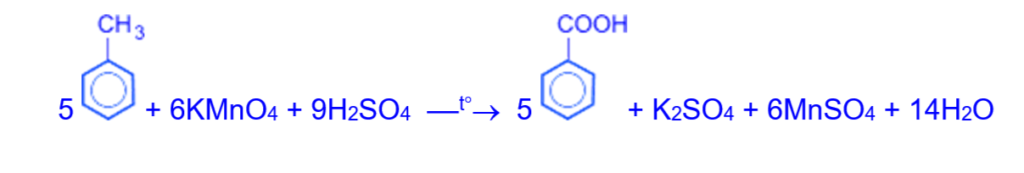
4. Ароматические кислоты синтезируют окислением гомологов бензола:
5. Гидролиз функциональных производных (сложных эфиров, ангидридов, галогенангидридов, амидов).
Химические свойства
- Из-за смещения электронной плотности от гидроксильной группы O–H к сильно поляризованной карбонильной группе C=O молекулы карбоновых кислот способны к электролитической диссоциации:
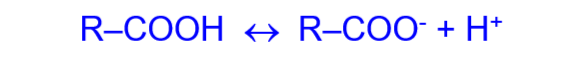
Сила карбоновых кислот в водном растворе невелика.
2. Карбоновые кислоты обладают свойствами, характерными для минеральных кислот. Они реагируют с активными металлами, основными оксидами, основаниями, солями слабых кислот.
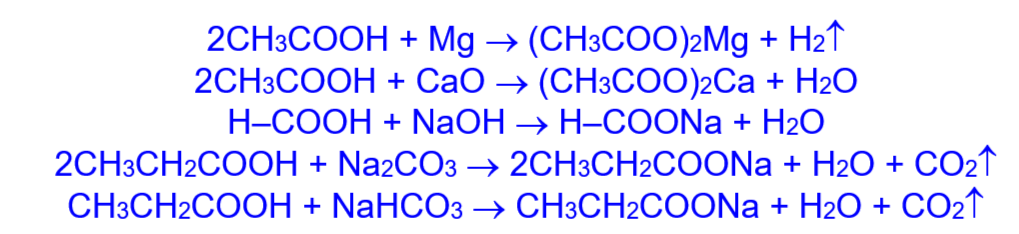
Карбоновые кислоты слабее многих сильных минеральных кислот (HCl, H2SO4 и т.д.) и поэтому вытесняются ими из солей:
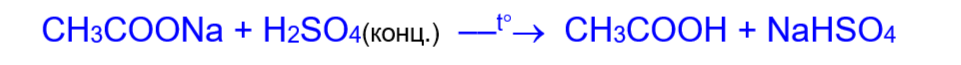
3. Образование функциональных производных:
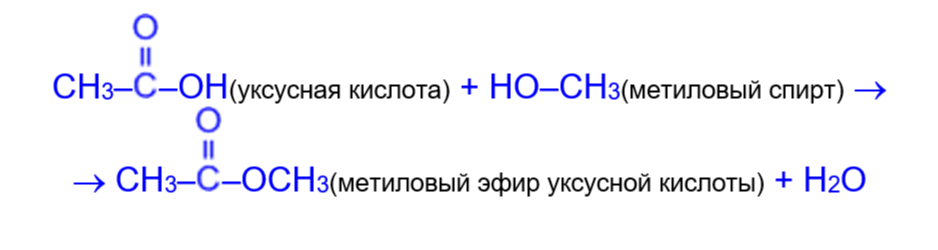
а) при взаимодействии со спиртами (в присутствии концентрированной H2SO4) образуются сложные эфиры. Образование сложных эфиров при взаимодействии кислоты и спирта в присутствии минеральных кислот называется реакцией этерификации (ester с латинского «эфир»).
Данную реакцию рассмотрим на примере образования метилового эфира уксусной кислоты из уксусной кислоты и метилового спирта:
Общая формула сложных эфиров
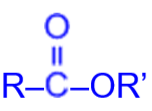
где R и R’ – углеводородные радикалы: в сложных эфирах муравьиной кислоты – формиатах –R=H.
Обратной реакцией является гидролиз (омыление) сложного эфира:
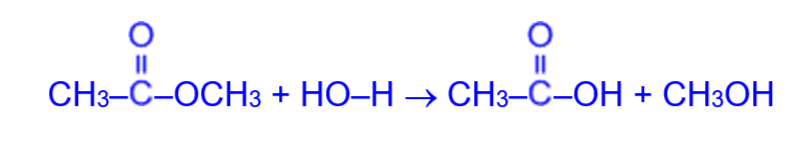
Как видно, процесс этерификации обратимый:
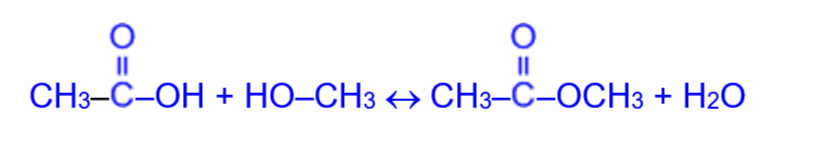
поэтому при наступлении химического равновесия в реакционной смеси будут находиться как исходные, так и конечные вещества.
Катализатор (ионы водорода) – одинаково ускоряют прямую и обратную реакции, то есть достижение равновесия. Чтобы сдвинуть равновесие в сторону образования эфира, следует брать в избытке исходные кислоту или спирт, или удалять один из продуктов реакции из сферы взаимодействия – например, отгоняя эфир или связывая воду водоотнимающими средствами.
Методом «меченых атомов» с помощью тяжёлого изотопа кислорода показано, что вода при этерификации образуется за счёт атома водорода спирта и гидроксила кислоты:

Учитывая этот факт, предложен следующий механизм реакции этерификации.
Кислород карбонильной группы кислоты захватывает протон, образуя оксониевый катион (I), который находится в равновесии с карбкатионом (II).
Молекула спирта атакует далее карбкатион (II), присоединяется к нему за счёт неподелённой пары электронов кислородного атома и образует оксониевый катион (III), который находится в равновесии с оксониевым катионом (IV).
От катиона (IV) отщепляется молекула воды, в результате чего образуется карбкатион (V), который находится в равновесии с оксониевым катионом (VI).
Оксониевый катион (VI) выбрасывает протон, являющийся катализатором реакции, приводя к молекуле конечного продукта – сложному эфиру.
б) при воздействии водоотнимающих реагентов в результате межмолекулярной дегидратации образуются ангидриды
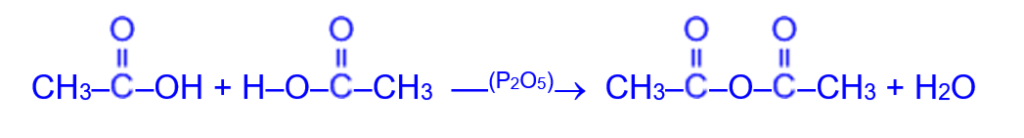
в) при обработке карбоновых кислот пятихлористым фосфором получают хлорангидриды
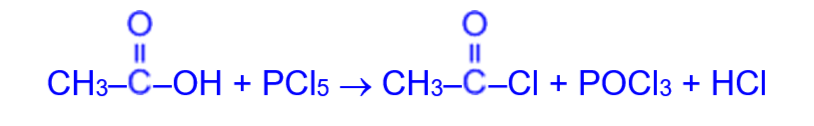
Гидролиз всех функциональных производных карбоновых кислот (ангидридов, хлорангидридов, сложных эфиров и др.) приводит в кислой среде к исходным карбоновым кислотам, а в щелочной среде – к их солям.
4. Галогенирование. При действии галогенов (в присутствии красного фосфора) образуются a-галогензамещённые кислоты:
α — Галогензамещённые кислоты – более сильные кислоты, чем карбоновые, за счёт — I эффекта атома галогена.
Применение
Муравьиная кислота – в медицине, в пчеловодстве, в органическом синтезе, при получении растворителей и консервантов; в качестве сильного восстановителя.
Уксусная кислота – в пищевой и химической промышленности (производство ацетилцеллюлозы, из которой получают ацетатное волокно, органическое стекло, киноплёнку; для синтеза красителей, медикаментов и сложных эфиров).
Масляная кислота – для получения ароматизирующих добавок, пластификаторов и флотореагентов.
Щавелевая кислота – в металлургической промышленности (удаление окалины).
Стеариновая C17H35COOH и пальмитиновая кислота C15H31COOH – в качестве поверхностно-активных веществ, смазочных материалов в металлообработке.
Олеиновая кислота C17H33COOH – флотореагент и собиратель при обогащении руд цветных металлов.