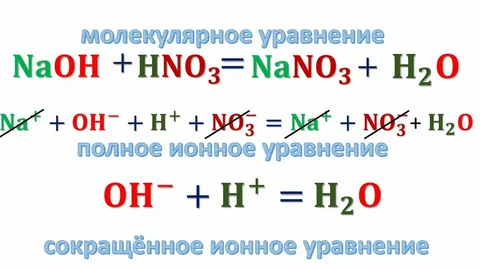
Ионные реакции в растворе
Реакции ионного обмена — это реакции между ионами, образовавшимися в результате диссоциации электролитов.
Правила составления уравнений ионных реакций
- Нерастворимые в воде соединения не диссоциируют.(простые вещества, оксиды, некоторые кислоты, основания и соли)
- В реакциях используют растворы веществ, поэтому даже малорастворимые вещества находятся в растворах в виде ионов.
- Если малорастворимое вещество образуется в результате реакции, то при записи ионного уравнения его считают нерастворимым.
- Сумма электрических зарядов ионов в левой и в правой части уравнения должна быть одинаковой.
Порядок составления уравнений ионных реакций
- Записывают молекулярное уравнение реакции
MgCl2 + 2AgNO3 = 2AgCl + Mg(NO3)2
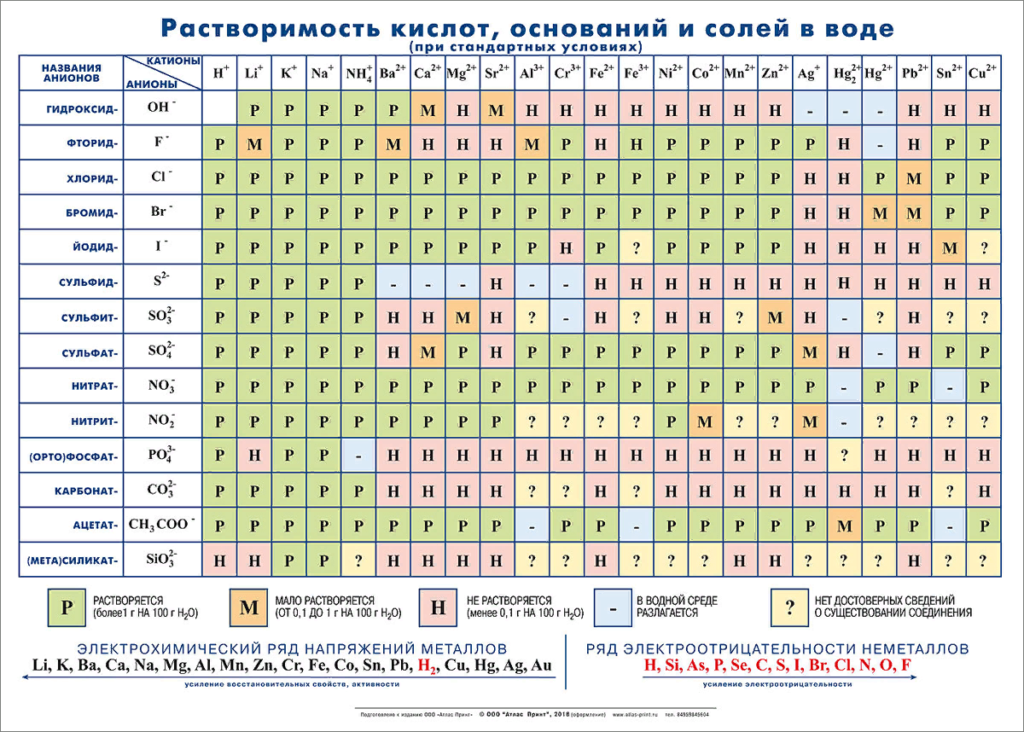
2. Определяют растворимость каждого из веществ с помощью таблицы растворимости
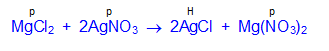
3. Записывают уравнения диссоциации растворимых в воде исходных веществ и продуктов реакции (на практике 3 пункт пропускают):
MgCl2 = Mg2+ + 2Cl—
AgNO3 = Ag+ + NO3—
Mg(NO3)2 = Mg2+ + 2NO3—
4. Записывают полное ионное уравнение реакции
Mg2+ + 2Cl— + 2Ag+ + 2NO3— = 2AgCl ↓ + Mg2+ + 2NO3—
5. Составляют сокращенное ионное уравнение, сокращая одинаковые ионы в левой и правой части уравнения:
Mg2+ + 2Cl— + 2Ag+ + 2NO3— = 2AgCl ↓ + Mg2+ + 2NO3—
Ag+ + Cl— = AgCl ↓
Условия необратимости реакций ионного обмена
- Если образуется осадок
Pb(NO3)2 + 2KI = PbI2 ↓ + 2KNO3
Pb2+ + 2I— = PbI2 ↓
2. Если выделяется газ
Na2CO3 + H2SO4 = Na2SO4 + H2O + CO2 ↑
CO32- + 2H+ = H2O + CO2 ↑
3. Если образуется малодиссоциированное вещество (H2O)
Ca(OH)2 + 2HNO3 = Ca(NO3)2 + 2H2O
H+ + OH— = H2O
4. Если образуются комплексные соединения (малодиссоциированные комплексные ионы)
CuSO4 • 5H2O + 4NH3 = [Cu(NH3)4]SO4 + 5H2O
Cu2+ + 4NH3 = [Cu(NH3)4]2+
В тех случаях, когда нет ионов, которые могут связываться между собой с образованием осадка, газа, малодиссоциированных соединений (H2O) или комплексных ионов реакции обмена обратимы.
Растворимость солей, кислот и оснований в воде
Таблица растворимости солей, кислот и оснований в воде
Задания:
Записать уравнения реакций в молекулярной, полной ионной и сокращенной ионной форме между следующими веществами, находящимися в водном растворе:
1) хлорида железа (III) и гидроксида натрия
2) карбоната калия и соляной кислоты
3) бромида цинка и нитрата серебра
4) гидроксида натрия и хлорида цинка
5) сульфата меди (II) и сульфида натрия
6) гидроксида калия и серной кислоты
7) карбоната кальция и ортофосфорной кислоты