ПЕРЕХОДНЫЕ МЕТАЛЛЫ
Переходные металлы — элементы побочных подгрупп периодической системы (d- и f- элементы).
Общие свойства
- Все переходные элементы- металлы имеют низкую электроотрицательность.
- Все элементы проявляют переменные степени окисления. Начиная с III группы низшая степень окисления имеет основной характер, высшая – кислотный, средние – амфотерный.
- Все элементы образуют комплексные соединения.
ПОДГРУППА ЖЕЛЕЗА
Свойства элементов подгруппы железа
| Атомный номер | Название | Электронная конфигурация | r г/см3 | t°пл. °C | t°кип. °C | ЭО | Атомный радиус, нм | Степень окисления |
| 26 | Железо Fe | [Ar] 3d64s2 | 7,87 | 1535 | 2750 | 1,64 | 0,128 | +2,+3 |
| 27 | Кобальт Co | [Ar] 3d74s2 | 8,9 | 1495 | 2870 | 1,7 | 0,125 | +2,+3 |
| 28 | Никель Ni | [Ar] 3d8 4s2 | 8,9 | 1453 | 2732 | 1,75 | 0,124 | +1,+2,+3,+4 |
Получение
металлов подгруппы железа
Восстановлением из оксидов углём или оксидом углерода (II)
FeO + C → Fe + CO
Fe2O3 + 3CO → 2Fe + 3CO2
NiO + C → Ni + CO
Co2O3 + 3C → 2Co + 3CO
Fe

d- элемент VIII группы; порядковый номер – 26; атомная масса – 56; (26p11; 30 n01), 26ē

Металл средней активности, восстановитель.
Основные степени окисления — +2, +3
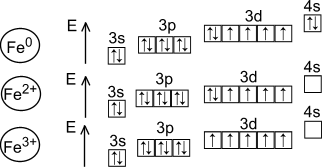
Железо и его соединения
Химические свойства
- На воздухе железо легко окисляется в присутствии влаги (ржавление):
4Fe + 3O2 + 6H2 O → 4Fe(OH)3
Накалённая железная проволока горит в кислороде, образуя окалину — оксид железа (II,III):
3Fe + 2O2 → Fe3O4
2. При высокой температуре (700–900°C) железо реагирует с парами воды:
3Fe + 4H2O –t° -> Fe3O4 + 4H2
3. Железо реагирует с неметаллами при нагревании:
2Fe + 3Br2 –t° -> 2FeBr3
Fe + S –t° -> FeS
4. Железо легко растворяется в соляной и разбавленной серной кислотах:
Fe + 2HCl -> FeCl2 + H2
Fe + H2SO4(разб.) -> FeSO4 + H2
В концентрированных кислотах–окислителях железо растворяется только при нагревании
2Fe + 6H2SO4(конц.) –t° -> Fe2(SO4)3 + 3SO2 + 6H2O
Fe + 6HNO3(конц.) –t° -> Fe(NO3)3 + 3NO2 + 3H2O
(на холоде концентрированные азотная и серная кислоты пассивируют железо).
5. Железо вытесняет металлы, стоящие правее его в ряду напряжений из растворов их солей.
Fe + CuSO4 → FeSO4 + Cu¯
Соединения двухвалентного железа
Гидроксид железа (II)
Образуется при действии растворов щелочей на соли железа (II) без доступа воздуха:
FeCl + 2KOH → 2KCl + Fе(OH)2¯
Fe(OH)2 — слабое основание, растворимо в сильных кислотах:
Fe(OH)2 + H2SO4 → FeSO4 + 2H2O
Fe(OH)2 + 2H+ → Fe2+ + 2H2O
При прокаливании Fe(OH)2 без доступа воздуха образуется оксид железа (II) FeO:
Fe(OH)2 –t° -> FeO + H2O
В присутствии кислорода воздуха белый осадок Fe(OH)2, окисляясь, буреет – образуя гидроксид железа (III) Fe(OH)3:
4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3
Соединения железа (II) обладают восстановительными свойствами, они легко превращаются в соединения железа (III) под действием окислителей:
10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
6FeSO4 + 2HNO3 + 3H2SO4 → 3Fe2(SO4)3 + 2NO + 4H2O
Соединения железа склонны к комплексообразованию (координационное число=6):
FeCl2 + 6NH3 → [Fe(NH3)6]Cl2
Fe(CN)2 + 4KCN → K4[Fe(CN)6](жёлтая кровяная соль)
Качественная реакция на Fe2+
При действии гексацианоферрата (III) калия K3[Fe(CN)6] (красной кровяной соли) на растворы солей двухвалентного железа образуется синий осадок (турнбулева синь):
3FeSO4 + 2K3[Fe(CN)6] → Fe3[Fe(CN)6]2¯ + 3K2SO4
3Fe2+ + 3SO42- +6K+ + 2[Fe(CN)6]3- → Fe3[Fe(CN)6]2¯ + 6K+ + 3SO42-
3Fe2+ + 2[Fe(CN)6]3- → Fe3[Fe(CN)6]2¯
Соединения трёхвалентного железа
Оксид железа (III)
Образуется при сжигании сульфидов железа, например, при обжиге пирита:
4FeS2 + 11O2 → 2Fe2O3 + 8SO2
или при прокаливании солей железа:
2FeSO4 –t° -> Fe2O3 + SO2 + SO3
Fe2O3 — основной оксид, в незначительной степени проявляющий амфотерные свойства
Fe2O3 + 6HCl –t° -> 2FeCl3 + 3H2O
Fe2O3 + 6H+ –t° -> 2Fe3+ + 3H2O
Fe2O3 + 2NaOH + 3H2O –t° -> 2Na[Fe(OH)4]
Fe2O3 + 2OH— + 3H2O → 2[Fe(OH)4]—
Гидроксид железа (III)
Образуется при действии растворов щелочей на соли трёхвалентного железа: выпадает в виде красно–бурого осадка
Fe(NO3)3 + 3KOH → Fe(OH)3¯ + 3KNO3
Fe3+ + 3OH— → Fe(OH)3¯
Fe(OH)3 – более слабое основание, чем гидроксид железа (II).
Это объясняется тем, что у Fe2+ меньше заряд иона и больше его радиус, чем у Fe3+, а поэтому, Fe2+ слабее удерживает гидроксид-ионы, т.е. Fe(OH)2 более легко диссоциирует.
В связи с этим соли железа (II) гидролизуются незначительно, а соли железа (III) — очень сильно. Для лучшего усвоения материалов этого раздела рекомендуется просмотреть видеофрагмент (доступен только на CDROM). Гидролизом объясняется и цвет растворов солей Fe(III): несмотря на то, что ион Fe3+ почти бесцветен, содержащие его растворы окрашены в жёлто-бурый цвет, что объясняется присутствием гидроксоионов железа или молекул Fe(OH)3, которые образуются благодаря гидролизу:
Fe3+ + H2O → [Fe(OH)]2+ + H+
[Fe(OH)]2+ + H2O → [Fe(OH)2]+ + H+
[Fe(OH)2]+ + H2O → Fe(OH)3 + H+
При нагревании окраска темнеет, а при прибавлении кислот становится более светлой вследствие подавления гидролиза. Fe(OH)3 обладает слабо выраженной амфотерностью: он растворяется в разбавленных кислотах и в концентрированных растворах щелочей:
Fe(OH)3 + 3HCl → FeCl3 + 3H2O
Fe(OH)3 + 3H+ → Fe3+ + 3H2O
Fe(OH)3 + NaOH → Na[Fe(OH)4]
Fe(OH)3 + OH— → [Fe(OH)4]—
Соединения железа (III) — слабые окислители, реагируют с сильными восстановителями:
2Fe+3Cl3 + H2S-2 → S0 + 2Fe+2Cl2 + 2HCl
Качественные реакции на Fe3+
- При действии гексацианоферрата (II) калия K4[Fe(CN)6] (жёлтой кровяной соли) на растворы солей трёхвалентного железа образуется синий осадок (берлинская лазурь):
4FeCl3 +3K4[Fe(CN)6] → Fe4[Fe(CN)6]3¯ + 12KCl
4Fe3+ + 12Cl— + 12K+ + 3[Fe(CN)6]4-→ Fe4[Fe(CN)6]3¯ + 12K+ + 12Cl—
4Fe3+ + 3 [Fe(CN)6]4- → Fe4[Fe(CN)6]3¯
2. При добавлении к раствору, содержащему ионы Fe3+ роданистого калия или аммония появляется интенсивная кроваво-красная окраска роданида железа(III):
FeCl3 + 3NH4CNS -> 3NH4Cl + Fe(CNS)3
(при взаимодействии же с роданидами ионов Fe2+ раствор остаётся практически бесцветным).
Применение
Чистое железо имеет довольно ограниченное применение. Его используют при изготовлении сердечников электромагнитов, как катализатор химических процессов.

Но сплавы железа — чугун и сталь — составляют основу современной техники. Находят широкое применение и многие соединения железа. Так, сульфат железа(III) используют при водоподготовке, оксиды и цианид железа служат пигментами при изготовлении красителей.

Железо и его сплавы, важнейшие конструкционные материалы в технике и промышленном производстве. Из сплавов железа с углеродом изготавливаются почти все конструкции в машиностроении и тяжелой промышленности.

Легковые, грузовые автомобили, станки, железные дороги, корпуса и силовые установки судов – все это делается в основном из стали. Масштаб производства стали является одной из основных характеристик общего технико-экономического уровня развития государства. На долю стали приходится около 95% всей металлической продукции.

Железо может входить в состав сплавов на основе других металлов — например, никелевых. Магнитная окись железа — важный материал в производстве устройств долговременной компьютерной памяти: жёстких дисков, дискет и т. п. Также железо входит в большинство магнитных сплавов.
Железо находит широкое применение в виде солей. Хлорид железа III (хлорное железо) используется в радиолюбительской практике для травления печатных плат. Десятиводный сульфат железа (железный купорос) в смеси с медным купоросом используется для борьбы с вредными грибками в садоводстве и строительстве. Железо применяется в качестве анода в железо-никелевых аккумуляторах, железо-воздушных аккумуляторах.
Задачи:
- С помощью каких реакций можно осуществить следующие превращения:
a) Fe304 → Fe → FeCl2 → FeCl3
б) FeSO4 → Fe(OH)2 → Fe(OH)3→ Fe2O3 → Fe
в) Fe → FeSO4 → Fe2(SO4)3 → Fe(OH)3 → Fe(NO3)3
Напишите уравнения реакций в молекулярной форме. - Железо массой 7 г прореагировало с хлором (хлор в избытке). Полученный хлорид растворили в воде массой 200 г. Вычислите массовую долю соли в полученном растворе.
- Используя значения стандартных электродных потенциалов, определите, может ли железо реагировать с водными растворами следующих веществ: а) CuSO4 б) ZnSO4; в) НСl; г) КСІ; д) Mn(NO3)2; e) AgNO3. Напишите уравнения соответствующих реакций.
- Сплав железа с углеродом массой 5 г поместили в соляную кислоту (кислота в избытке). По окончании реакции объем выделившегося водорода составил 1,96 л (нормальные условия). Вычислите массовую долю углерода в сплаве с железом.
- В состав железной руды входят магнетит Fe304 (массовая доля 65%) и другие вещества, которые не содержат железо. Вычислите массу железа, которое можно получить из руды массой 800 кг
- Железо с углеродом образует карбид, в котором массовая доля железа равна 93,3%. Определите простейшую формулу этого карбида