Алкинами называют углеводороды состава CnH2n-2, содержащие одну тройную углерод-углеродную связь. Родоначальником гомологического ряда этих углеводородов является ацетилен C2H2 структурная формула
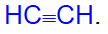
Алкины называют также ацетиленами, или замещенными ацетиленами.
Изомерия
Алкинам свойственна изомерия углеродного скелета (начиная с C5H8), изомерия положения тройной связи (начиная с C4H6) и межклассовая изомерия с алкадиенами.
Получение
В промышленном масштабе для технических целей ацетилен получают высокотемпературным пиролизом метана.
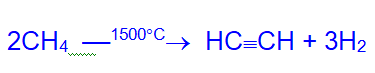
Физические свойства
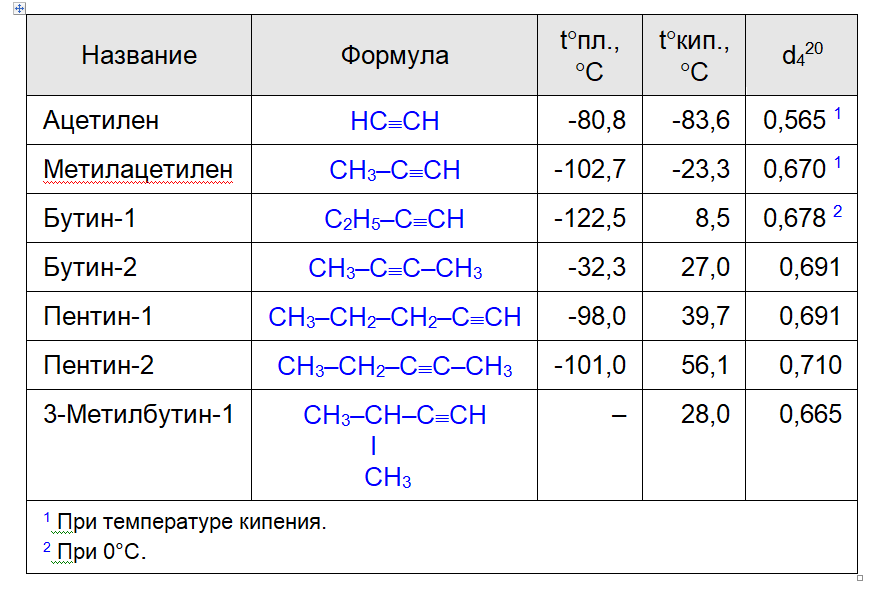
По физическим свойствам алкины напоминают алкены и алканы. Температуры их плавления и кипения увеличиваются с ростом молекулярной массы. В обычных условиях алкины С2–С3 – газы, С4–С16 – жидкости, высшие алкины – твердые вещества. Наличие тройной связи в цепи приводит к повышению температуры кипения, плотности и растворимости их в воде по сравнению с олефинами и парафинами. Физические свойства некоторых алкинов сведены в таблице.
Таблица. Физические свойства некоторых алкинов
Химические свойства
Углеродные атомы в молекуле ацетилена находятся в состоянии sp-гибридизации. Это означает, что каждый атом углерода обладает двумя гибридными sp- орбиталями, оси которых расположены на одной линии под углом 180° друг к другу, а две p- орбитали остаются негибридными.
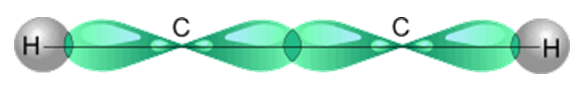
sp- Гибридные орбитали двух атомов углерода в состоянии,
предшествующем образованию тройной связи и связей C–H
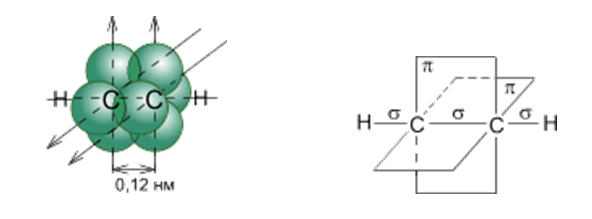
Схематическое изображение строения молекулы ацетилена (ядра атомов углерода и водорода на одной прямой, две p- связи между атомами углерода находятся в двух взаимно перпендикулярных плоскостях)
Две негибридные p- орбитали каждого атома углерода, расположенные перпендикулярно друг другу и перпендикулярно направлению σ-связей, взаимно перекрываются и образуют две p-связи. Таким образом, тройная связь характеризуется сочетанием одной σ- и двух 𝝅-связей.
Для алкинов характерны все реакции присоединения, свойственные алкенам, однако у них после присоединения первой молекулы реагента остается еще одна 𝝅-связь (алкин превращается в алкен), которая вновь может вступать в реакцию присоединения со второй молекулой реагента. Кроме того, «незамещенные» алкины проявляют кислотные свойства, связанные с отщеплением протона от атома углерода, составляющего тройную связь
I. Реакции присоединения
- Гидрирование. Гидрирование алкинов осуществляется при нагревании с теми же металлическими катализаторами (Ni, Pd или Pt), что и в случае алкенов, но с меньшей скоростью.
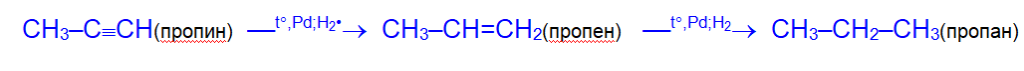
2. Галогенирование. Алкины обесцвечивают бромную воду (качественная реакция на тройную связь). Реакция галогенирования алкинов протекает медленнее, чем алкенов.
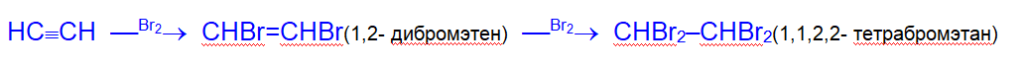
3. Гидрогалогенирование. Образующиеся продукты определяются правилом Марковникова.

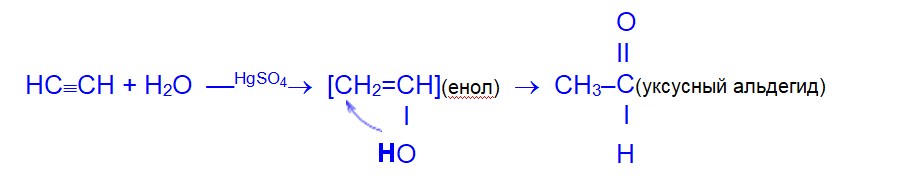
4. Гидратация (реакция Кучерова). Присоединение воды осуществляется в присутствии сульфата ртути. Эту реакцию открыл и исследовал в 1881 году М.Г.Кучеров.
Присоединение воды идет по правилу Марковникова, образующийся при этом неустойчивый спирт с гидроксильной группой при двойной связи (так называемый, енол) изомеризуется в более стабильное карбонильное соединение — кетон.
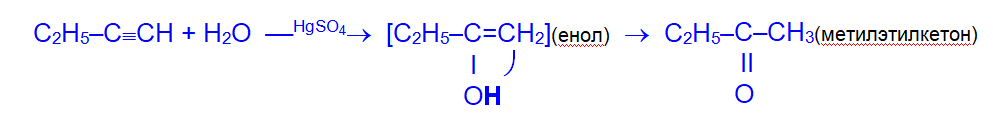
В случае гидратации собственно ацетилена конечным продуктом является альдегид.
5. Полимеризация. Ацетиленовые углеводороды ввиду наличия тройной связи склонны к реакциям полимеризации, которые могут протекать в нескольких направлениях:
— Под воздействием комплексных солей меди происходит димеризация и линейная тримеризация ацетилена.
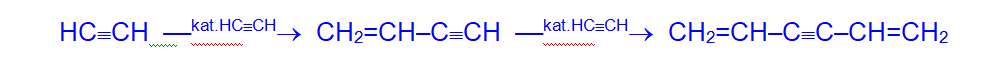
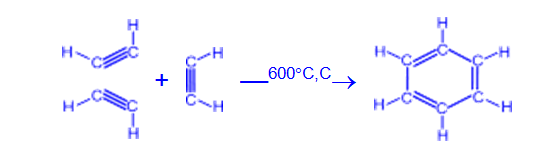
— При нагревании ацетилена в присутствии активированного угля (реакция Зелинского) осуществляется циклическая тримеризация с образованием бензола.
II. Кислотные свойства
Водородные атомы ацетилена способны замещаться металлами с образованием ацетиленидов. Так, при действии на ацетилен металлического натрия или амида натрия образуется ацетиленид натрия.
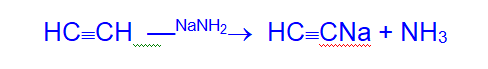
Ацетилениды серебра и меди получают взаимодействием с аммиачными растворами соответственно оксида серебра и хлорида меди.
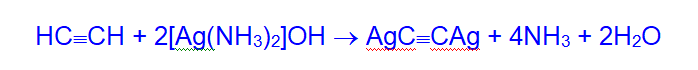
Ацетилениды серебра, меди обладают исключительной взрывчатостью. Они легко разлагаются при действии соляной кислоты.
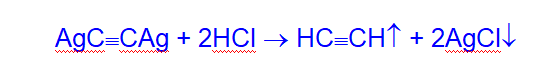
Данным свойством ацетиленидов пользуются при выделении ацетиленовых углеводородов из смесей с другими газами.
Применение
При горении ацетилена в кислороде температура пламени достигает 3150°C, поэтому ацетилен используют для резки и сварки металлов. Кроме того, ацетилен широко используется в органическом синтезе разнообразных веществ — например, уксусной кислоты, 1,1,2,2- тетрахлорэтана и др. Он является одним из исходных веществ при производстве синтетических каучуков, поливинилхлорида и других полимеров.
Задачи:
- Назовите по заместительной номенклатуре следующие углеводороды
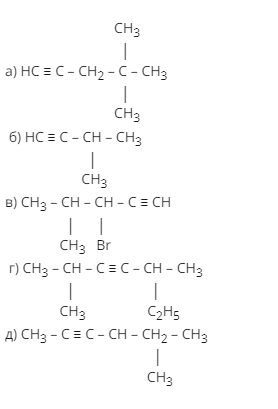
2. Напишите структурные формулы следующих алкинов
а) 3 — метилпентина — 1
б) 2,5 — диметил — 6 — этилоктина — 3
в) 5 — метил — 4 — изопропилгексина — 2
г) 2 — этил — 5,5,6 — триметилнонина — 3
3. Напишите структурные формулы алкинов, соответствующих формуле C5H8. И назовите их по заместительной номенклатуре
4. Сколько изомеров соответствует эмпирической формуле C6H10. Определите их названия.